|
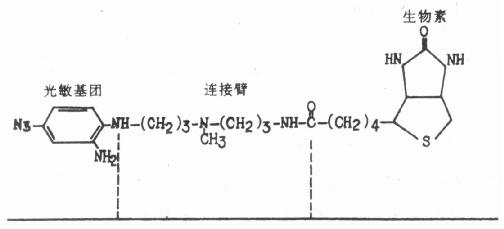
第一节 原位杂交组织化学概述 一、核酸分子杂交技术 1961年Hall开拓了液相核酸杂交技术的研究,其基本原理是利用核酸分子单链之间有互补的碱基顺序,通过碱基对之间非共价键的形成,出现稳定的双链区,形成杂交的双链。自此以后,由于分子生物学技术的迅猛发展,特别是70年代末到80年代初,分子克隆、质粒和噬菌体DNA的构建成功,核酸自动合成仪的诞生,大大丰富了核酸探针的来源,新的核酸分子杂交类型和方法不断涌现。按其作用方式可大致分为固相杂交和液相杂交两种:液相杂交是指参加反应的两条核酸链都游离在溶液中,而固相杂交是将参加反应的一条核酸链固定在固体的支持物上(常用的有硝酸纤维素滤膜,其它如尼龙膜、乳胶颗粒和微孔板等),另一条参加反应的核酸链游离在溶液中。固相杂交有菌落原位杂交(colony in situ hybridization)、斑点杂交法(Dot blot)、Southern印迹杂交(Southern blot)、Northern印迹杂交(Northern blot)和组织原位杂交(Tissue in situ hybridization),即原位杂交组织化学技术和原位杂交免疫细胞化学技术。液相分子杂交技术包括吸附杂交、发光液相杂交、液相夹心杂交和复性速率液相分子杂交等(详见第十八章 )。 二、原位杂交组织化学技术的由来及发展 原位杂交组织(或细胞)化学技术简称原位杂交(In situ hybridization),如上所述,属于固相核酸分子杂交的范畴。但它区别于固相核酸分子杂交中的任何一种核酸分子杂交技术。菌落杂交系细菌裂解释放出DNA,然后进行杂交。Southern印迹杂交法是以鉴定DNA中某一特定的基因片段,而Norhtern印迹杂交法是用以检测某一特定的RNA片段的。它们都只能证明该病原体、细胞或组织中是否存在待测的核酸而不能证明该核酸分子在细胞或组织中存在的部位。1969年美国耶鲁大学Gall 和Pardue首先用爪蟾核糖体基因探针与其卵母细胞杂交,确定该基因定位于卵母细胞的核仁中。与此同时,Buongiorno – Nardelli和Amaldi,John及其同事等相继利用同位素标记核酸探针进行了细胞或组织的基因定位,从而创造了原位杂交细胞或组织化学技术。Orth(1970)应用3H标记的兔乳头状瘤病毒cRNA探针与兔乳头状瘤组织的冰冻切片进行杂交,首次用原位杂交检测了病毒DNA在细胞中的定位,但当时的工作多采用冰冻组织切片或培养细胞,探针均采用同位素标记。 由于同位素标记探针具有放射性既污染环境,又对人体有害,且受半衰期限制等缺点,科学工作者们开始探索用非放射性的标记物标记核酸探针进行原位杂交。Bauman(1981)等首先应用荧光素标记cRNA探针做原位杂交,然后用荧光显微镜观察获得成功。Shroyer(1982)报道用2,4二硝基苯甲醛(DNP)标记DNA探针,使该DNA探针具有抗原性,然后用兔抗DNP的抗体来识别杂交后的探针,最后经免疫过氧化物酶的方法来定位杂交探针。这两种方法至今仍有采用,但因敏感度不够高,应用不够普遍。 Pezzella(1987)创建了用磺基化DNA探针来做细胞或组织原位杂交的方法,其基本原理是使DNA探针的胞嘧啶碱基磺基化,利用单克隆抗体识别磺基化探针,再通过免疫组化方法显示结合的单克隆抗体,从而对杂交结合的探针进行定位。本法的优点是磺基化DAN探针标记简便,不需作缺口平移标记,敏感度也较高。但自生物素和高辛标记探针技术建立后,已有取而代之的趋势。生物素标记探针技术是Brigat(1983)首先建立的,它利用生物素标记的探针在组织切片上检测了病毒DNA,通过生物素与抗生物素结合,过氧化物酶-抗过氧化物酶显示系统显示病毒DNA在细胞中的定位。生物素标记探针技术目前已被广泛应用,特别是在病毒学和病理学的临床诊断中。这种生物素标记技术又叫酶促生物素标记技术。另一种叫光促生物素标记核酸技术,该技术是用光敏生物素(Photobiotin)标记核酸。目前应用的光敏生物素有乙酸盐和补骨脂素生物素,它们都是由三个部分组成:光敏基团、连结臂和生物素(图20-1)。在强光下,不需酶反应,光敏生物素的光敏基团即可与核酸中的碱基相结合。光敏生物素标记核酸,方法简单,灵敏度也不低,但标记效率不高,每100~150个碱基才能标记一个生物素,对于短的基因探针特别是寡核苷酸探针不宜使用,以免因标记数过少而影响灵敏度(Forster et al 1985)。
图20-1 光敏生物素结构图 近年来,地高辛(Digoxigonin)标记技术引起科技工作者的极大兴趣。Boeringer Mannhem Bio-chemisca于1987年将地高辛标记的有关试剂及药盒投放市场。和其它非放射性标记物一样,地高辛较放射性标记系统安全,方便、省时间。同时在敏感性和质量控制方面比生物素标记技术要优越,可以检测出人基因组DNA中的单拷贝基因。地高辛标记法显示的颜色为紫蓝色(标记碱性磷酸酶-抗碱性磷酸酶显色系统),有较好的反差背景。 核酸探针根据标记方法的不同可粗略分为放射性探针和非放射性探针两类。根据探针的核酸性质不同可分为DNA探针、RNA探针、cDNA探针、cRNA探针和寡核苷酸探针等。DNA探针还有单链DNA(Single stranded, ssDNA)和双链DNA(Double stranded, dsDNA)之分(详见十九章 )。早期应用的主要是DNA探针,继之Temin在70年代研究致癌RNA病毒时制备了cDNA探针(complementary DNA),其基本原理是以RNA为模板,经逆转录酶(reverse transcriptase)又称为RNA指导的DNA聚合酶催化产生的。该酶以RNA为模板,按照RNA的核苷酸顺序合成DNA,这一途径与一般遗传信息流的方向相反,故称逆转录。CDNA是指互补于mRNA的DNA分子。RNA探针是将特异性的cDNA片段插入含有相当的RNA聚合酶启动子的转录性载体。这类载体包括pSP64和pSP65,它们具有不同的启动子在多克隆位点的各侧。Psp64和pSP65在sP6启动子的多克隆位点的方向是不同的。通过改变外源基因的插入方向或选用不同的RNA聚合酶,可以控制RNA的转录方向,即以哪条DNA链为模反转录RNA。从而可以得到与mRNA同序列的同义RNA探针(Sense probe)和与mRNA互补的反义RNA探针(antisense probe),又称互补RNA探针(complementary RNA probe , cRNA)。通常用同义RNA探针做为反义RNA探针的阴性对照。由于RNA探针是单链分子,所以它与靶序列的杂交反应极高。有报告认为其杂交率高于DNA探针的8倍。 DNA合成仪的诞生使制造寡核苷酸探针成为可能,与上述探针不同的是寡核苷酸探针不是克隆性DNA探针,它是由DNA合成仪依照所需杂交的靶核苷酸序列合成的。具有制造方便,价格低廉的优点,也可进行放射性与非放射性标记,但其特异性不如克隆性探针强,亦不如其杂交信号高。 原位杂交组织化学技术在近20年的发展可以说是飞跃的,其突出的特点是由分子遗传学研究提供的探针大量增加,探针生产的可靠性和速率大大发展了,更重要的是非放射性标记物的发展使原位杂交组织化学技术在不久的将来将和现今的免疫细胞化学技术一样成为实验室的常规技术和临床日常应用的诊断技术。新的非放射性标记技术正在继续不断涌现。Coulton(1991)建议将非放射性标记技术更名为亲合复合物标记技术(Affinity – Complex Labelled Probes, ACLP )。因为“非(non)“在英文里是一个否定的名词,而且根据非放射性标记技术的原理是将一个标记物利用其亲合性,应用直接或间接的方法结合在核苷酸分子上。 原位杂交组织化学技术在生命科学的研究中可视为一项革命性的技术。它使它们的研究从器官、组织和细胞水平走向分子水平。为各个学科的研究带来突破性的进展。其中特别突出的是细胞或组织的基因表达、染色体分析、病毒诊断和发育生物学。我们在下节 将详加叙述。 三、原位杂交组织化学技术的基本方法 如前所述,由于核酸探针的种类和标记物的不同,在具体应用的技术方法上也各有差异,但其基本方法和应用原则大致相同。大致可分为:①杂交前准备,包括固定、取材、玻片和组织的处理,如何增强核酸探针的穿透性、减低背景染色等;②杂交;③杂交后处理;④显示(visual-ization):包括放射性自显影和非放射性标记的显色。 (一)固定 原位杂交组织化学技术(In Situ Hybridization Histochemistry, ISHH)在固定剂的应用和选择上应兼顾到三个方面:保持细胞结构,最大限度地保持细胞内DNA或RNA的水平;使探针易于进入细胞或组织。DNA是比较稳定的,mRNA是相对稳定的但易为酶合成和降解。RNA却绝然不同,非常容易被降解。因此,对于DNA的定位来说,固定剂的种类和浓度并不十分重要。相反,在RNA的定位上,如果要使RNA的降解减少到最低限度,那么,不仅固定剂的种类浓度和固定的时间十分重要,而且取材后应尽快予以冷冻或固定。在解释ISHH的结果时应考虑到取材至进入固定剂或冰冻这段时间对RNA保存所带来的影响,因组织中mRNA的降解是很快的。在固定剂中,最常用的是多聚甲醛。和其它的固定剂(如戊二醛)不同,多聚甲醛不会与蛋白质产生广泛的交叉连接,因而不会影响探针穿透入细胞或组织。其它如醋酸-酒精的混合液和Bouin’s固定剂也能获得较满意的效果。对于mRNA的定位,我们常采用的方法是将组织固定于4%多聚甲醛磷酸缓冲液中1~2h,在冷冻前浸入15%蔗糖溶液中,置4℃冰箱过夜,次日切片或保存在液氮中待恒冷箱切片机或振荡切片机切片。组织也可在取材后直接置入液氮冷冻,切片后才将其浸入4%多聚甲醛约10min,空气干燥后保存在-70℃。如冰箱温度恒定,在-70℃可保存数月之久不会影响杂交结果。在病理学活检取材多用福尔马林固定和石蜡包埋,这种标本对检测DNA和mRNA有时也可获得杂交信号,但石蜡包埋切片由于与蛋白质交叉连接的增加,影响核酸探针的穿透,因而杂交信号常低于冰冻切片。同时,在包埋的过程中可减低mRNA的含量。其它固定剂如应用多聚甲醛蒸汽固定干燥后的冷冻切片也可获得满意效果。各种固定剂均有各自优缺点,如沉淀性(Precipitating)固定剂:酒精/醋酸混合液、Bouin’s液、Carnoy’s液等能为增加核酸探针的穿透性提供最佳条件,但它们不能最大限度地保存RNA,而且对组织结构有损伤。戊二醛能较好地保存RNA和组织形态结构,但由于和蛋白质产生广泛的交叉连接,从而大大地影响了核酸探针的穿透性。至今,多聚甲醛仍被公认为ISHH较为理想的固定剂。 (二)玻片和组织切片的处理 1.玻片的处理玻片包括盖片和载片应用热肥皂刷洗,自来水清洗干净后,置于清洁液中浸泡24h,清水洗净烘干,95%酒精中浸泡24h后蒸馏水冲洗、烘干,烘箱温度最好在150℃或以上过夜以去除任何RNA酶。盖玻片在有条件时最好用硅化处理,锡箔纸包裹无尘存放(硅化方法见附录)。 由于ISHH的实验周期长,实验程序繁杂,因此,要应用粘附剂预先涂抹在玻片上,干燥后待切片时应用,以保证在整个实验过程中切片不致脱落。常用的粘附剂有铬矾-明胶液,其优点是价廉易得,但在长周期实验过程中,粘附效果不够理想。多聚赖氨酸液具有较好的粘附效果,但价格昂贵,需进口。近年Vector Lab (U.S.A.)推出一种新的粘附剂叫Vectorband Reagent,每一单位包装可制备500~700张载玻片,粘附效果极佳,价格较多聚赖氨酸便宜,制片后可长期保存应用。目前国内尚无生产,需国外进口(配方见附录2)。 2.增强组织的通透性和核酸探针的穿透性此步骤根据应用固定剂的种类、组织的种类、切片的厚度和核酸探针的长度而定。比如用戊二醛固定的组织由于其与蛋白质产生广泛的交叉连接就需要应用较强的增强组织通透性的试剂。增强组织通透性常用的方法如应用稀释的酸洗涤、去垢剂(detergent)或称清洗剂Triton X-100、酒精或某些消化酶如胃蛋白酶、胰蛋白酶、胶原蛋白酶和淀粉酶(diastase)等。这种广泛的去蛋白作用无疑可增强组织的通透性和核酸探针的穿透性,提高杂交信号,但同时也会减低RNA的保存最和影响组织结构的形态,因此,在用量及孵育时间上应慎为掌握。 (责任编辑:泉水) |
第一节 原位杂交组织化学概述
时间:2006-06-25 14:12来源:大众医药网 作者:admin 点击:
387次
顶一下
(5)
100%
踩一下
(0)
0%
------分隔线----------------------------
- 上一篇:第二节 cRNA探针在原位杂交组织化学
- 下一篇:第二十章 原位杂交组织化学
- 发表评论
-
- 最新评论 进入详细评论页>>