|
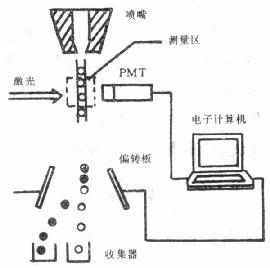
第一节 流式细胞术简介 一、流式细胞术发展简史 流式细胞术(Flow Cytometry, FCM)是一种可以对细胞或亚细胞结构进行快速测量的新型分析技术和分选技术。其特点是:①测量速度快,最快可在1秒种内计测数万个细胞;②可进行多参数测量,可以对同一个细胞做有关物理、化学特性的多参数测量,并具有明显的统计学意义;③是一门综合性的高科技方法,它综合了激光技术、计算机技术、流体力学、细胞化学、图像技术等从多领域的知识和成果;④既是细胞分析技术,又是精确的分选技术。 概要说来,流式细胞术主要包括了样品的液流技术、细胞的分选和计数技术,以及数据的采集和分析技术等。FCM目前发展的水平凝聚了半个世纪以来人们在这方面的心血和成果。 1934年,Moldavan1首次提出了使悬浮的单个血红细胞等流过玻璃毛细管,在亮视野下用显微镜进行计数,并用光电记录装置计测的设想,在此之前,人们还习惯于测量静止的细胞,因为要使单个细胞顺次流过狭窄管道容易造成较大的细胞和细胞团块的淤阻。1953年Crosland –Taylor根据雷诺对牛顿流体在圆形管中流动规律的研究认识到:管中轴线流过的鞘液流速越快,载物通过的能力越强,并具有较强的流体动力聚集作用。于是设计了一个流动室,使待分析的细胞悬浮液都集聚在圆管轴线附近流过,外层包围着鞘液;细胞悬浮液和鞘液都在作层液。这就奠定了现代流式细胞术中的液流技术基础。 1956年,Coulter在多年研究的基础上利用Coulter效应生产了Coulter 计数器。其基本原理是:使细胞通过一个小孔,只在细胞与悬浮的介质之间存在着导电性上的差异,便会影响小孔道的电阻特性,从而形成电脉冲信号,测量电脉冲的强度和个数则可获得有关细胞大小和数目方面的信息。1967年Holm等设计了通过汞弧光灯激发荧光染色的细胞,再由光电检测设备计数的装置。1973年Steinkamp设计了一种利用激光激发双色荧光色素标记的细胞,既能分析计数,又能进行细胞分选的装置。这样就基本完成了现代FCM计数技术的主要历程。 现代的FCM数据采集和分析技术是从组织化学发源的,其开拓者是Kamentsky。1965年,Kamentsky在组织化学的基础上提出了两个新设想:(1)细胞的组分是可以用光光度学来定量测定的,即分光光度术可以定量地获得有关细胞组织化学的重要信息。(2)细胞的不同组分可以同时进行多参数测量,从而可以对细胞进行分类。换句话说,对同一细胞可以同时获得有关不同组分的多方面信息,用作鉴别细胞的依据。Kamentsky不仅思路敏捷,而且能身体力行。他是第一个把计算机接口接到仪器上并记录分析了多参数数据的人,也是第一个采用了二维直方图来显示和分析多参数的人。 流式细胞术在细胞化学中的应用的先驱者是Van Dilla和美国的Los Alamos小组。他们在1967年研制出流液束、照明光轴、检测系统光轴三者相互正交的流式细胞计的基础上,首次用荧光Feulgen反应对DNA染色显示出DNA的活性与荧光之间存在着线性关系,并在DNA的直方图上清楚地显示出细胞周期的各个时相。Gohde 和Dittrich接着把这项技术推向实用,他们用流式细胞术测定细胞周期借以研究细胞药代动力学问题。FCM用于免疫组织化学中的关键是对细胞进行免疫荧光染色,其它和在细胞化学的应用并没有多大差异。 近20年来,国内外在FCM上都做了不少的研究和应用工作,也取得了不少成果。特别是随着仪器和方法和日臻完善,人们越来越致力于样品制备、细胞标记、软件开发等方面的工作以扩大FCM的应用领域和使用效果。FCM在免疫组织化学中的应用也大致差不多,并注重了在临床应用的推广。 二、流式细胞计的基本结构和工作原理 流式细胞计是对细胞进行自动分析和分选的装置。它可以快速测量、存贮、显示悬浮在液体中的分散细胞的一系列重要的生物物理、生物化学方面的特征参量,并可以根据预选的参量范围把指定的细胞亚群从中分选出来。多数流式细胞计是一种零分辨率的仪器,它只能测量一个细胞的诸如总核酸量,总蛋白量等指标,而不能鉴别和测出某一特定部位的核酸或蛋白的多少。也就是说,它的细节 分辨率为零。国外又把流式细胞计称作荧光激活细胞分选器(Flu-orescence Activated Cell Sorter, FACS)。美国Becton—Dickinson 公司生产的流式细胞计系列均冠以FACS字头。目前我国国内使用的仪器多为美国、西欧及日本等国的产品,国内有些单位也已研制成功,但尚无定型产品面市。 1.流式细胞计的基本结构流式细胞计主要由四部分组成。它们是:流动室和液流系统;激光源和光学系统;光电管和检测系统;计算机和分析系统。图10-1为其结构示意图。
图10-1 流式细胞计结构示意图 (1)流动室和液流系统:流动室由样品管、鞘液管和喷嘴等组成,常用光学玻璃、石英等透明、稳定的材料制作。设计和制作均很精细,是液流系统的心脏。样品管贮放样品,单个细胞悬液在液流压力作用下从样品管射出;鞘液由鞘液管从四周流向喷孔,包围在样品外周后从喷嘴射出。为了保证液流是稳液,一般限制液流速度υ<10m/s。由于鞘液的作用,被检测细胞被限制在液流的轴线上。流动室上装有压电晶体,受到振荡信号可发生振动。 (2)激光源和光学系统:经特异荧光染色的细胞需要合适的光源照射激发才能发出荧光供收集检测。常用的光源有弧光灯和激光;激光器又以氩离子激光器为普遍,也有配和氪离子激光器或染料激光器。光源的选择主要根据被激发物质的激发光谱而定。汞灯是最常用的弧光灯,其发射光谱大部分集中于300~400nm,很适合需要用紫外光激发的场合。氩离子激光器的发射光谱中,绿光514nm和蓝光488nm的谱线最强,约占总光强的80%;氪离子激光器光谱多集中在可见光部分,以647nm较强。免疫学上使用的一些荧光染料激发光波长在550nm以上,可使用染料激光器。将有机染料做为激光器泵浦的一种成份,可使原激光器的光谱发生改变以适应需要即构成染料激光器。例如用氩离子激光器的绿光泵浦含有Rhodamine 6G水溶液的染料激光器,则可得到550~650nm连续可调的激光,尤在590nm处转换效率最高,约可占到一半。为使细胞得到均匀照射,并提高分辨率,照射到细胞上的激光光斑直径应和细胞直径相近。因此需将激光光束经透镜会聚。光斑直径d可由下式确定:d=4λf/πD。λ为激光波长;f为透镜焦距;D为激光束直径。色散棱镜用来选择激光的波长,调整反射镜的角度使调谐到所需要的波长λ。为了进一步使检测的发射荧光更强,并提高荧光讯号的信噪比,在光路中还使用了多种滤片。带阻或带通滤片是有选择性地使某一滤长区段的光线滤除或通过。例如使用525nm带通滤片只允许FITC(Fluoresceinisothiocyanate,异硫氰荧光素)发射的525nm绿光通过。长波通过二向色性反射镜只允许某一波长以上的光线通过而将此波长以下的另一特定波长的光线反射。在免疫分析中常要同时探测两种以上的波长的荧光信号,就采用二向色性反射镜,或二向色性分光器,来有效地将各种荧光分开。 (3)光电管和检测系统:经荧光染色的细胞受合适的光激发后所产生的荧光是通过光电转换器转变成电信号而进行测量的。光电倍增管(PMT)最为常用。PMT的响应时间短,仅为ns数量级;光谱响应特性好,在200~900nm的光谱区,光量子产额都比较高。光电倍增管的增益从103到108可连续调节 ,因此对弱光测量十分有利。光电管运行时特别要注意稳定性问题,工作电压要十分稳定,工作电流及功率不能太大。一般功耗低于0.5W;最大阳极电流在几个毫安。此外要注意对光电管进行暗适应处理,并注意良好的磁屏蔽。在使用中还要注意安装位置不同的PMT,因为光谱响应特性不同,不宜互换。也有用硅光电二极管的,它在强光下稳定性比PMT好。 从PMT输出的电信号仍然较弱,需要经过放大后才能输入分析仪器。流式细胞计中一般备有两类放大器。一类是输出信号辐度与输入信号成线性关系,称为线性放大器。线性放大器适用于在较小范围内变化的信号以及代表生物学线性过程的信号,例DNA测量等。另一类是对数放大器,输出信号和输入信号之间成常用对数关系。在免疫学测量中常使用对数放大器。因为在免疫分析时常要同时显示阴性、阳性和强阳性三个亚群,它们的荧光强度相差1~2个数量级;而且在多色免疫荧光测量中,用对数放大器采集数据易于解释。此外还有调节 便利、细胞群体分布形状不易受外界工作条件影响等优点。 (4)计算机和分析系统:经放大后的电信号被送往计算机分析器。多道的道数是和电信号的脉冲高度相对应的,也是和光信号的强弱相关的。对应道数年纵坐标通常代表发出该信号的细胞相对数目。多道分析器出来的信号再经模-数转换器输往微机处理器编成数据文件,或存贮于计算机的硬盘和软盘上,或存于仪器内以备调用。计算机的存贮容量较大,可存贮同一细胞的6~8个参数。存贮于计算机内的数据可以在实测后脱机重现,进行数据处理和分析,最后给出结果。除上述四个主要部分外,还备有电源及压缩气体等附加装置。 2.流式细胞计的工作原理下面分别简要介绍流式细胞计有关的参数测量、样品分选及数据处理等工作原理。 (1)参数测量原理:流式细胞计可同时进行多参数测量,信息主要来自特异性荧光信号及非荧光散射信号。测量是在测量区进行的,所谓测量区就是照射激光束和喷出喷孔的液流束垂直相交点。液流中央的单个细胞通过测量区时,受到激光照射会向立体角为2π的整个空间散射光线,散射光的波长和入射光的波长相同。散射光的强度及其空间分布与细胞的大小、形态、质膜和细胞内部结构密切相关,因为这些生物学参数又和细胞对光线的反射、折射等光学特性有关。未遭受任何损坏的细胞对光线都具有特征性的散射,因此可利用不同的散射光信号对不经染色活细胞进行分析和分选。经过固定的和染色处理的细胞由于光学性质的改变,其散射光信号当然不同于活细胞。散射光不仅与作为散射中心的细胞的参数相关,还跟散射角、及收集散射光线的立体角等非生物因素有关。 在流式细胞术测量中,常用的是两种散射方向的散射光测量:①前向角(即0。角)散射(FSC);②侧向散射(SSC),又称90。角散射。这时所说的角度指的是激光束照射方向与收集散射光信号的光电倍增管轴向方向之间大致所成的角度。一般说来,前向角散射光的强度与细胞的大小有关,对同种细胞群体随着细胞截面积的增大而增大;对球形活细胞经实验表明在小立体角范围内基本上和截面积大小成线性关系;对于形状复杂具有取向性的细胞则可能差异很大,尤其需要注意。侧向散射光的测量主要用来获取有关细胞内部精细结构的颗粒性质的有关信息。侧向散射光虽然也与细胞的形状和大小有关,但它对细胞膜、胞质、核膜的折射率更为敏感,也能对细胞质内较大颗粒给出灵敏反映。 在实际使用中,仪器首先要对光散射信号进行测量。当光散射分析与荧光探针联合使用时,可鉴别出样品中被染色和未被染色细胞。光散射测量最有效的用途是从非均一的群体中鉴别出某些亚群。 荧光信号主要包括两部分:①自发荧光,即不经荧光染色细胞内部的荧光分子经光照射后所发出的荧光;②特征荧光,即由细胞经染色结合上的荧光染料受光照而发出的荧光,其荧光强度较弱,波长也与照射激光不同。自发荧光信号为噪声信号,在多数情况下会干扰对特异荧光信号的分辨和测量。在免疫细胞化学等测量中,对于结合水平不高的荧光抗体来说,如何提高信噪比是个关键。一般说来,细胞成分中能够产生的自发荧光的分子(例核黄素、细胞色素等)的含量越高,自发荧光越强;培养细胞中死细胞/活细胞比例越高,自发荧光越强;细胞样品中所含亮细胞的比例越高,自发荧光越强。 (责任编辑:泉水) |
第一节 流式细胞术简介
时间:2006-06-25 14:12来源:大众医药网 作者:admin 点击:
180次
顶一下
(7)
100%
踩一下
(0)
0%
------分隔线----------------------------
- 发表评论
-
- 最新评论 进入详细评论页>>