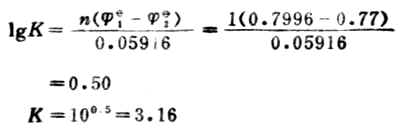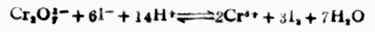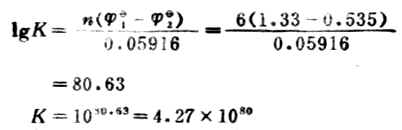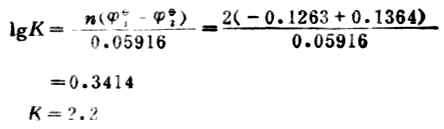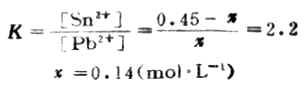|
第三节 电极电位的应用 一、判断氧化还原反应自发进行的方向 电池反应都是自发进行的氧化还原反应。因此电池反应的方向即氧化还原反应自发进行的方向。判断氧化还原反应进行的方向时,可将反应拆为两个半反应,求出电极电位。然后根据电位高的为正极起还原反应,电位低的为负极起氧化反应的原则,就可以确定反应自发进行的方向。如果两个电对的 例9 判断298K时下列反应进行的方向:
解:将上述反应写成两个半反应,并查出它们的标准电极是位:
标准电动势为:Eφ= =0.7804(V)。 因为Eφ<0.2V,可直接用 为了证明这个结论的正确性,我们可以按非标准态的电池反应计算电动势。
电池电动势为:E= =0.6325(V) 因为E<0,上述反应可自发地向右进行。 例10 判断298K时反应
当[HAsO2]=[H3AsO4]=1mol.L-1,[I-]=1mol.L-1,在中性和酸性([H+]=1mol.L-1)溶液中反应进行的方向。 解:将上述反应写成两个半反应,并查出它们的标准电极电位:
在中性溶液中,[H+]=1.0*10-71mol.L-1。
=0.559+0.059161g[H+] =0.559+0.059161g10-7 =0.559+0.414 =0.145(V) 因为 剂。因而上述反应能自发地向右进行。即 HAsO2+I2+2H2O→H3AsO4+2I-+2H+ 当溶液中氢离子浓度为1mol.L-1时, 因为 述反应能自发地向右进行。即 H3AsO4+2I-+2H+→HAsO2+I2+2H2O 二、判断氧化还原反应进行的程度 氧化还原反应属可逆反应,同其他可逆反应一样,在一定条件下也能达到平衡。随着反应不断进行,参与反应的各物质浓度不断改变,其相应的电极电位也在不断变化。电极电位高的电对的电极电位逐渐降低,电极电位低的电对的电极电位逐渐升高。最后必定达到两电极电位相等,则原电池的电动势为零,此时反应达到了平衡,即达到了反应进行的限度。利用能斯特方程式和标准电极电位表可以算出平衡常数,判断氧化还原反应进行的程度。若平衡常数值很小,表示正向反应趋势很小,正向反应进行得不完全;若平衡常数值很大,表示正向反应可以充分地进行,甚至可以进行到接近完全。因此平衡常数是判断反应进行 程度的标志。 氧化还原K与反应中两个电对的标准电极电位的关系为:
式中,n—反应中得失电子数; 由式(6-4)可见, 例11 计算下列反应在298K时的平衡常数,并判断此的以应进行的程度。
解: 电极反应Ag++e-→Ag Fe2+→Fe3++e-
此反应平衡常数很小,表明此正反应进行得很不完全。 例12 计算下列反应的298K时的平衡常数,并判断此反应进行的程度。
解:
电极反应 Cr2O72-+14H++6e-+→2Cr3+7H2O 2I-→I2+2e- 此反应的平衡常数很大,表明此正反应能进行完全,实际上可以认为能进行到底。 例13 向0.45mol.L-1铅盐溶液中加锡,发生下列反应,
计算298K时反应的平衡常数,达到反应限度时溶液中Pb2+浓度为多少。 解: 电极反应:Pb2++2e-→Pb Sn→Sn2++2e-
设平衡(达到反应限度)时溶液中Pb2+浓度为χmol.L-1。
χ 0.45-χ
即达到反应限度时溶液中Pb2+浓度为0.14mol.L-1。 三、 电位法测定溶液的PH值 如果有H+或OH-参加电极反应,则H+浓度对电极电位会有影响。把这个电极作为指示电极和一个参比电极组成电池,测定电池电动势,就可以算出指示电极的电位,溶液中H+浓度即溶液的PH值。 所谓指示电极就是这一电极的电位与溶液中某种离子浓度的关系符合能斯特方程式。从它所显示的电位可以推算出溶液中这种离子的尝试通常把这种电极看作是待测离子的指示电极。测定溶液的PH值,就是测定溶液中H+浓度,因此要采用氢离子指示电极。所谓参比电极是指电极电位稳定且已知其准确数值的电极。 (责任编辑:泉水) |
第三节 电极电位的应用
时间:2006-07-01 21:43来源:大众医药网 作者:admin 点击:
342次
顶一下
(10)
100%
踩一下
(0)
0%
------分隔线----------------------------
- 发表评论
-
- 最新评论 进入详细评论页>>
 值相差较大(即Eφ),浓度的变化对电位的影响不大,不致于使反应改变方向。因此,当Eφ<0.2V 时,即使不处于标准状态,也可直接用
值相差较大(即Eφ),浓度的变化对电位的影响不大,不致于使反应改变方向。因此,当Eφ<0.2V 时,即使不处于标准状态,也可直接用 

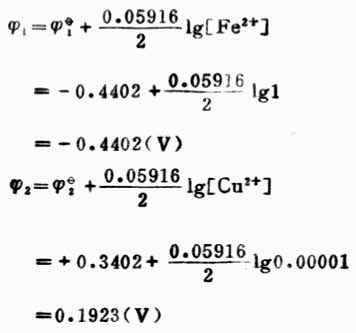
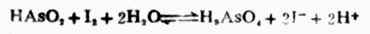
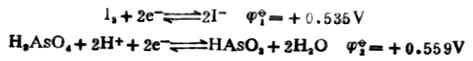
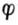 1=
1=
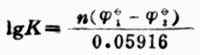 (6-4)
(6-4)
 1=+0.7996V
1=+0.7996V