|
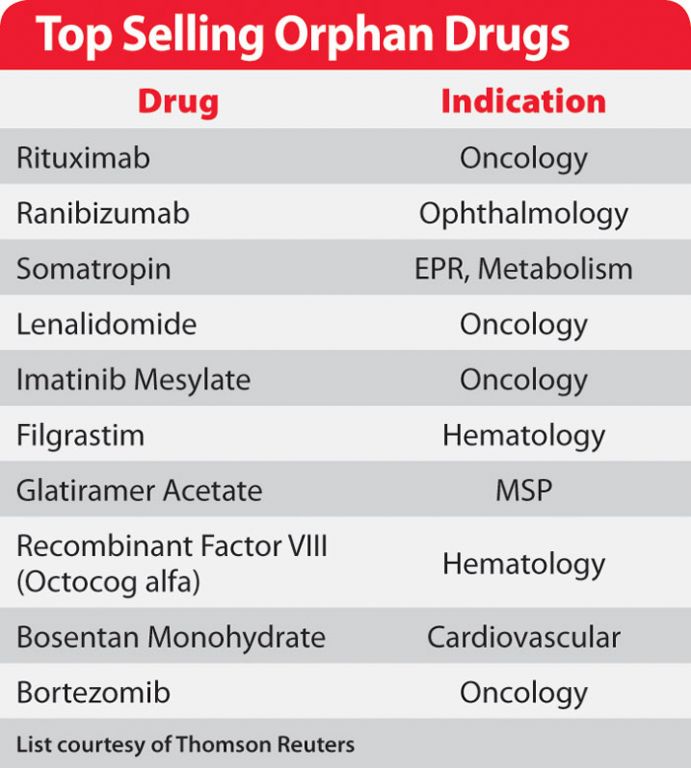
首先要说明的是,孤儿药并非是针对孤儿的药,孤儿最需要的不是“药”,而是“爱”。我不清楚中文“孤儿药”最初的来源,但我估计很可能不是中文首创,而是英文Orphan Drug的直译,取自孤儿孤苦无依且乏人重视的概念。我国目前尚没有一种自主研发成功的孤儿药,本文的主要内容不得不主要谈美国和欧盟对孤儿药的研发情况。对于孤儿药的话题,经检索,科学网此前几乎没有博文是专门针对这个话题的,整个互联网上的相关中文信息和资料也不多,深入介绍的,更是没有看到,也从一个侧面显示我国在这方面和欧美的巨大差距。本文力图就孤儿药这个话题,做一个相对全面的综述介绍,本文为第一部分,希望能够抛砖引玉,引起科学网博友的进一步深入讨论。 说孤儿药,首先还要先谈孤儿病或者说罕见病,目前,我国并并没有一个官方的明确的罕见病定义。也没有一个明确的数字(发病率)来划分罕见病和普通病,因为在世界上某个地方或者某个特定群体被视为罕见病的疾病,在别的地方却可能很常见。世界卫生组织(WHO)将罕见病定义为患病人数占总人口0.65‰-1‰的疾病,常见的有白血病、地中海贫血、血友病、苯丙酮尿症、白化病、法布瑞病、成骨不全症、戈谢病等(1),绝大多数(有报道说是80%)罕见病是遗传病,因此,即使病人在出生后不出现症状,也会伴随病人一生。很多罕见病在病人婴幼儿时期就出现症状,大约30%罕见病儿童在5岁前病逝 (5)。在美国,罕见病是指受影响病人在20万人(限于美国)之下的疾病,而欧盟的定义则是发病率在万分之五的病,据估计,美国47%的罕见病的病人人数少于2万5千人 (2), 最罕见的罕见病到底有多罕见呢?!有一种基因缺乏症, 目前确诊病人,全球只有一个病人,这个病(即ribose-5-phosphate isomerase deficiency)被视为最罕见的罕见病(不能更罕见了!)。研究表明,大约十分之一的美国人患有罕见病 (5)。据估计,在美国和欧洲,共有超过5千5百万人患用罕见病,而我国总人口远超过美国和欧洲的人口总和,据估计,我国共有超过1千万罕见病患者。美国FDA认可6000种罕见病,欧盟版FDA,即EMA(European Medicines Agency)认可8000种罕见病(4)。自从1983年美国国会通过孤儿药法案以来,美国FDA已经批准约350种孤儿药(包括生物药)用于治疗大约200种罕见病。所以即使是在美国,绝大多数罕见病迄今仍然是无药可治,但这也显示孤儿药还有很大的市场空间。 孤儿药原本是指药企对这类药缺乏兴趣(主要是由于单一病种病人数量少,市场小),然而,最近几年,越来越多的欧美大中小药企开始进入孤儿药,从这个意义上,孤儿药确实是不算孤独。上述趋势从近几年美国FDA批准上市的孤儿药情况也可以看出。2012年FDA共批准了39种新药,其中,孤儿药为13种,占了33%,事实上,在过去6年中,FDA批准的孤儿药所占比例为33-37% (3)。FDA新药办公室主任John Jenkins预测以后FDA批准的新药中孤儿药所占比例还会进一步增长(3)。顺便提一下,在2012年FDA批准的13种孤儿药中,有一种药(即Kalydeco)被美国《福布斯》杂志视为2012年最重要的药(参见我的另一博文:2012年最重要的新药),该药用于治疗囊性纤维化跨膜转导调节器(CFTR)基因发生了特定的G551D突变(即CFTR蛋白上的第551氨基酸G突变成了D),并且年龄≥6岁的罕见囊性纤维化(CF)的患者。 孤儿药的研发在欧美,尤其是美国近年来的快速发展是有多种原因的,其中很重要的一点是相关法规的制定、实施,在政策上对孤儿药的研发进行鼓励和引导, 在经济上也有补偿机制。如上所述,美国在30年前,即1983年通过了孤儿药法案(即ODA, Orphan Drug Act),2002年通过了罕见病法案,欧盟也类似的法案,只是欧盟对罕见病的定义更宽泛一些,将主要在发展中国家才有的热带病也列入其中。ODA对美国的孤儿药的研发促进作用是巨大而明显的,在ODA实施前,即1983年前,FDA批准的所有新药中,总共只有38种是用来治疗罕见病的,从1983年1月刀2004年,共有1129种不同的化合物或生物制品以孤儿药审批途径进入临床实验,最终有249种孤儿药被批准上市,截至2010年5月,美国共有353种孤儿药被FDA批准, 截至目前(2013年4月14日,这一数字达到了至少377。ODA的主要内容和对孤儿药的研发的促进主要表现在:1)联邦政府对药企在孤儿药的研发经费退税(最高可达50%),以及相关竞争性联邦经费支持;2)增强专利和孤儿药市场化保护;3)快速审批程序;4)规模更小的临床实验。最后这一点恐怕是最重要的,在新药研发中,最大的开销是在临床实验上,尤其是在最后一步多达上千病人(对一般药而言)的3期临床实验上,许多研发过程中的药就是死在最后这个关口上,也意味着此前数以亿计(美元)的前期投资都打了水漂,所以,新药研发不但周期长(一般8-10年),风险也很高,而孤儿药研发风险则大大降低,不但研发过程中可以得到联邦经费支持,临床实验阶段的开销也大大降低,有的孤儿药,即使是在3期临床阶段只有几十个病人也最终批准上市了(就是想多找病人也不是那么容易的)。并且,孤儿药一般定价都很高,一般每个病人需要花费20万到50万美元(2) (当然基本都是保险公司买单),上面提到的新药Kalydeco就需要每位病人花29万4千美元,并且还要终生服药。所以孤儿药,对药企而言可谓是投资少,收益大,尽管孤儿药不大可能成为销售额高达上百亿美元的重磅药,但是在这个重磅药时代即将结束的时候(阿斯利康老总云),孤儿药显然即使对国际制药巨头们而言,也是挡不住的诱惑(本博文的续集将会详细介绍,敬请关注)。 就全球而言,据汤姆逊路透的报告显示(4),2000年到2010年10年间,孤儿药的复合年增长率为26%,高于普通药的20%。孤儿药大约占整个药物市场的22%,即近四分之一。目前,全球孤儿药年销售额约500亿美元。值得一提的是,孤儿药也并非都是治疗一些我们闻所未闻的罕见病。更常见的孤儿药只是一些常见病(如肿瘤和血液病)中的一些亚型。如下表所示,目前全球最畅销的10种孤儿药主要都是治疗如肿瘤(oncology)和血液病(hematology)等看起来似乎常见的疾病的。事实上,在去年FDA批准的13种孤儿药中就有6种是治疗肿瘤(癌症)的,2011年,11种孤儿药中更有7种是治肿瘤的 (3)。 (责任编辑:泉水) |
并不孤独的孤儿药(上篇): 孤儿药概述
时间:2013-05-02 11:28来源:科学网博客 作者:未知 点击:
212次
顶一下
(0)
0%
踩一下
(0)
0%
------分隔线----------------------------
- 上一篇:并不孤独的孤儿药(中篇): 群雄逐鹿
- 下一篇:药物效力“导航仪”说了算
- 发表评论
-
- 最新评论 进入详细评论页>>
- 推荐内容
-
- 2018创新药投资策略:资本涌入、洗
导语 医药产业作为支撑医疗卫生事业和健康服务业发展的重要基...
- 23andMe与药企合作,拿用户的数据来
上个月,美国基因测序公司23andMe与两家制药公司签署了两笔合作...
- 天津医药大品牌战略 盈利水平连四
天津医药集团把结构调整、转型升级作为主攻方向,围绕化学与...
- 2013年国内3800亿基本药物市场待释放
新版《基本药物目录》5月正式实施。 对医药企业来说,基药目...
- 研发创新药,这条路我们要走下去
在为期3天的中国(泰州)医药博览会上,各个医药厂商纷纷展示...
- Nat.Med.:β-arrestin 2研究开辟AD药物研
来自VIB及KULeuven大学的科学家,发现了一种可用于阿尔茨海默氏...
- 2018创新药投资策略:资本涌入、洗