 |
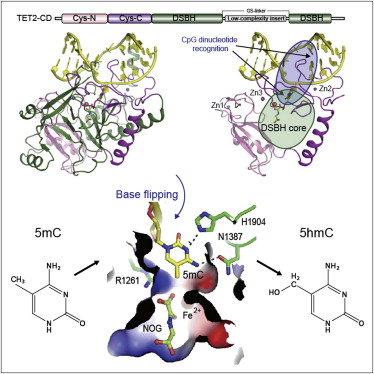
我国研究人员首次成功解析哺乳动物骨髓造血关键蛋白TET2的三维结构,被认为对研究多种疾病的发病机制,尤其对血液肿瘤(如髓系白血病)治疗性药物开发具有重大意义。 复旦大学生物医学研究院研究员徐彦辉及其课题组胡璐璐、李泽和程净东等的相关研究成果,今天凌晨在线发表于国际顶级学术期刊《细胞》杂志上,引人关注。 哺乳动物TET蛋白家族有TET1蛋白、TET2蛋白和TET3蛋白3个成员。TET蛋白在哺乳动物发育和骨髓造血等关键生命过程中扮演着至关重要的角色,如果TET蛋白失去活性(丧失功能)的话,就会导致各种疾病的发生,尤其会罹患血液肿瘤。 经过4年多时间艰辛攻关,课题组最终运用X射线晶体学等研究方法,获得了TET2蛋白和DNA两者结合在一起的三维结构。研究发现,TET1蛋白在急性髓细胞性白血病中与致癌蛋白MLL发生融合后,会导致哺乳动物罹患癌症。进一步的研究又发现,血液肿瘤患者血液中含有多种TET2蛋白突变,且突变率很高,影响了TET2蛋白的活性,最终引起疾病发生。而TET1在急性髓细胞性白血病形成过程中,则扮演了“致病帮凶”的角色。 徐彦辉课题组研究成果的重大意义在于:下一步的研究可以通过对TET2蛋白三维结构的分析、计算机模拟、高通量的化合物筛选等方法,找到能够激活TET2蛋白,或抑制TET1蛋白活性的相关药物,进而可能为找到抗血液肿瘤药物提供“导航”。 据悉,2009年以来,全球至少有数十家著名研究机构都在研究TET蛋白的三维结构,以求有所突破,但始终未有结果。(记者 施捷 通讯员 孙国根) 东方网12月7日消息:昨天,复旦大学生物医学研究院传出消息:该院研究员徐彦辉率领的团队经过4年潜心研究,首次成功解析了哺乳动物骨髓造血关键蛋白TET2的三维结构。这一研究成果将对揭示疾病发病机制、开发血液肿瘤(如髓系白血病)治疗性药物等具有重要意义。目前,该成果已在线发表于国际顶级学术期刊《细胞》杂志上。 专家介绍,人体遗传物质DNA上有一种甲基化特殊标记,如果这一标记位点紊乱,就会导致各种疾病(尤其是血液肿瘤疾病)的发生。 长期以来,科学家对甲基化标记添加至DNA的过程早有定论,至于甲基化标记怎样被“去除”,最终致病,总是找不到确切答案。直至2009年,有科学家发现哺乳动物体内的TET蛋白,对甲基化标记的去除发挥关键作用,至于这种蛋白具体是如何作用的,始终是个谜。 由徐彦辉领衔的课题组,进行长达4年的艰辛攻关,最终发现TET蛋白与DNA的三维结构,揭开了谜底。专家形象地说,TET蛋白家族拥有三个成员,即TET1蛋白、TET2蛋白、TET3蛋白。利用X射线晶体学等研究方法,团队发现,TET2蛋白特别聪明,它能自动识别、找到甲基化标记,并将甲基化标记修饰过的DNA翻转到TET2蛋白内部;随后,在内部铁离子的帮助下发生氧化反应,将标记逐步添加至DNA甲基化标记上。进一步研究发现,血液肿瘤患者中含有多种TET2蛋白突变,且突变率很高;正是因为这些突变影响了TET2蛋白的活性,导致它“消极怠工”、无所作为,导致甲基化标记被“去除”,从而致病。而TET2蛋白的“同胞兄弟”TET1蛋白却是个“致病帮凶”,在急性髓细胞性白血病中,TET2蛋白与致癌蛋白MLL发生融合,会导致哺乳动物罹患癌症。 业内专家评价,来自复旦大学的研究意义重大。接下来,科学家们可以在此基础上,通过对TET2蛋白的三维结构分析、计算机模拟、高通量化合物筛选等方法,找到能激活TET2蛋白、或抑制TET1蛋白活性的药物,从而为人类战胜血液肿瘤作出贡献。 来自复旦大学上海医学院,遗传工程国家重点实验室等处的研究人员破解了TET2 - DNA复合物的晶体结构,这将有助于了解TET介导的5mC氧化机理,从而为解析包括癌症在内的各种相关疾病进程提供了一个结构基础。这一研究成果公布在12月5日Cell杂志在线版上。 领导这一研究的是复旦大学上海医学院,生科院的徐彦辉教授,其早年毕业于清华大学, 2008年在复旦大学生物医学研究院组建结构生物学实验室。研究方向为染色质组装和修饰的调控机制、肿瘤发生信号转导通路、药物先导化合物的设计和筛选。 DNA的胞嘧啶(C)5-甲基化是一种重要的表观修饰,它参与基因调节、基因组印记、X-染色体失活、重复序列抑制和癌症发生等过程,其中5-甲基胞嘧啶(5mC)可被TET (ten-eleven translocation)蛋白家族进一步转化为5-羟甲基胞嘧啶(5hmC),该过程是DNA去甲基化的1个必要阶段。 TET蛋白包括3个成员:Tet1、Tet2和Tet3,均属于α-酮戊二酸和Fe2+依赖的双加氧酶,研究表明Tet2突变常与髓系恶性病有关。在这篇文章中,研究人员报道了人类Tet2与甲基化DNA的结晶结构(分辨率2.02 Å)。这有助于解析Tet介导的5mC氧化作用机理。 从这一结构中,研究人员发现了两个锌指结构,将富含Cys和DSBH结构域连接在一起,形成一个紧凑的催化结构域。 其中富含Cys的结构域有助于DSBH核心上的DNA,Tet2能特异性识别CpG核苷酸,并表现出5mC底物偏好性。研究人员还发现5mC能通过甲基化基团插入到催化中心里,这一甲基化基团并不涉及TET2 –DNA之间的作用,因此催化中心中TET2能允许5mC衍生物进行进一步的氧化。 这些作用机制还涉及与人类癌症有关的DNA相互作用,锌螯合剂残基等。这些研究为理解的TET-介导的5mC氧化机理提供了一个结构基础。 |
复旦学者解析哺乳动物TET蛋白三维结构
时间:2013-12-09 20:40来源:中国生物技术信息网 作者:未知 点击:
304次
顶一下
(0)
0%
踩一下
(0)
0%
------分隔线----------------------------
- 上一篇:PNAS:肌肉萎缩症的最新发现
- 下一篇:Cell:华裔杰出青年解析B类GPCR结构
- 发表评论
-
- 最新评论 进入详细评论页>>
- 推荐内容
-
- 近五年毒理学研究机构的研究论文
5 印度的研究机构比较 在印度的研究机构(表 5 )中,印度科学...
- 美国出台BRAIN计划伦理问题报告
美国生物伦理问题研究总统委员会近日发布了首个报告 —— 将...
- 高胆固醇或致怀孕难
对某些怀孕困难的夫妇来说,问题也许与其胆固醇水平高有关。...
- 生命科学研究评价的新指标
文献计量学是以文献体系和文献计量特征为研究对象,采用数学...
- 脑科学计划何去何从?
题名: Whereto the mega brain projects? 作者: Mu-ming Poo 单位: Instit...
- 生物学标志记录岁月的痕迹
你知道自己衰老的速度如何么? 先别忙着去偷看网上“生物年龄...
- 近五年毒理学研究机构的研究论文
