|
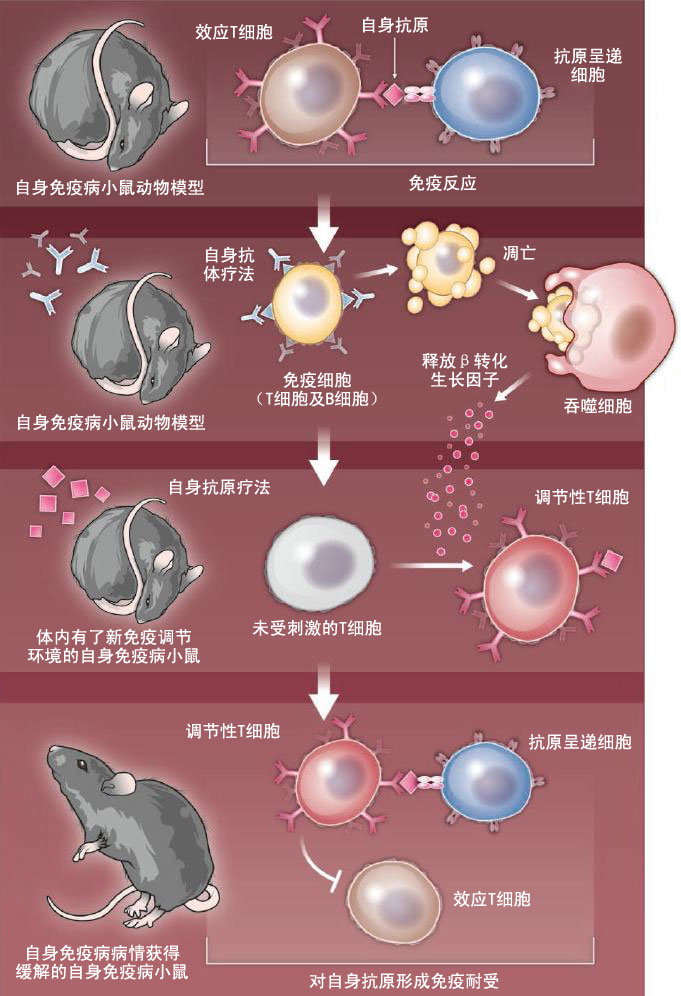
研究发现,一种抗炎环境(anti-inflammatory milieu)有助于诱导形成免疫耐受(immune tolerance)。 免疫系统能够为机体提供保护,免受感染性病原体(infectious agents)的侵害,同时也能够在肿瘤出现的第一时间消灭它们,但是在发挥这些免疫保护功能的同时,又能够保持机体的完整性。而保持机体的完整性就意味着机体的免疫系统不会攻击自身组织。这种和平共处的作用就是所谓的免疫耐受(immune tolerance)机制,但是当机体发生自身免疫性疾病(autoimmune disease)时,比如患上多发性硬化症(multiple sclerosis),或者胰岛素依赖型糖尿病(insulin-dependent diabetes)时,这种免疫耐受机制就会被打破。因此如何恢复机体内的免疫耐受就成了治疗这些疾病的关键所在。Kasagi等人发现,的确有可能重建机体的免疫耐受机制,让机体的免疫系统重新获得识别自身组织的能力。 多种自身免疫疾病的病理机制都涉及原发性自身免疫反应或继发性自身免疫反应,而且这些疾病已经继心血管疾病和癌症之后,成为了发病率和致死率排名第三的疾病。不过目前还没有彻底治愈自身免疫疾病的好办法。对于多发性硬化症、全身性红斑狼疮(lupus erythematosus),或者类风湿性关节炎(rheumatoid arthritis)这类会给机体重要器官带来严重损伤,让人失能(disabling)的疾病,最常见的治疗手段也无非就是使用对机体免疫功能进行全面抑制的免疫抑制药物(immunosuppressive drugs)进行长期维持治疗。可是这样一来,患者就非常容易被各种感染性病原体侵入,同时罹患肿瘤的机率也会大大增加。 免疫耐受机制并不是与生俱来的一项保护机制。而是在胎儿的成长发育过程中,以及出生之后慢慢建立起来的一种自身保护机制,主要依赖于淋巴细胞分化的重要场所——淋巴气管(比如胸腺和骨髓)里的多种功能,同时也需要脾脏(spleen)、淋巴结(lymph nodes)、肠内淋巴组织(intestinal lymphoid tissue)等外周二级淋巴器官,以及炎症作用靶标器官等多种组织的参与和作用。最近研究发现,调节性T细胞(regulatory T cells, Tregs)在维持免疫耐受机制中发挥了重要的中枢性作用,这也让使用Tregs细胞进行细胞治疗(即提取自身免疫病患者自身的Tregs细胞,进行体外培养扩增之后再回输给患者,进行治疗的一种方法)成为了一种可能。不过现在开展的这类试验使用的都是多克隆Tregs细胞,所以并不是抗原特异性的治疗手段,但是对抗原特异性的Tregs细胞进行体外培养现在还比较困难。所以有人提出了一个变通的方案,在体内促使针对自身抗原的Tregs细胞(autoantigen-specific Treg cell)分化和扩增,这样既能够起到治疗的作用,同时也不会影响正常的免疫保护功能。 吞噬细胞(phagocytic cell)分泌的大量免疫调控细胞因子(immunoregulatory cytokine)β转化生长因子(transforming growth factor–β, TGF-β)能够抑制异常的、无限增殖的炎症反应,而这种免疫反应恰好就是自身免疫病的一大标志。当机体内有细胞凋亡(apoptosis)时,吞噬细胞就会“吃掉”这些行将就木的细胞,同时释放出大量的β转化生长因子。所以如何刺激自身免疫病患者体内的免疫环境(immune environment)中产生出足够数量的凋亡细胞,刺激机体释放出大量的β转化生长因子,促进Tregs细胞形成,重建自身免疫耐受机制就成为了一个非常重要的问题。 Kasagi等人用两种不同的小鼠动物模型向我们展示了这种方案的可行性。这两种小鼠动物模型分别是人工诱导的自身免疫性大脑炎(autoimmune encephalitis)小鼠动物模型(这是一种多发性硬化症动物模型)和非肥胖糖尿病小鼠(nonobese diabetic mice, NOD mice)中的自发性胰岛素依赖型糖尿病(spontaneous insulin-dependent diabetes)小鼠动物模型。Kasagi等人首次诱导产生出了足够的吞噬细胞来治疗自身免疫病。他们通过对小鼠进行全身γ射线照射,摧毁了小鼠全身60~80%的免疫细胞,包括吞噬细胞,然后再输入正常的吞噬细胞,以及让小鼠发病的自身免疫抗原(autoantigen)。结果让人大吃一惊,这些自身免疫病小鼠全都痊愈了,详见附图。Kasagi等人证实,吞噬细胞、这些细胞分泌的β转化生长因子,以及由此产生的特异性针对自身免疫病抗原的Tregs细胞全都是治疗自身免疫病的关键组份,缺一不可。
不破不立。科研人员使用两种手段在自身免疫病小鼠体内重建了免疫耐受功能。小鼠体内的免疫细胞首先在能够特异性识别这些免疫细胞的抗体的作用下,经由凋亡途径死亡。然后再用特异性的自身抗原刺激小鼠,产生抗原特异性的调节性T细胞。这些T细胞就能够抑制同样针对这些自身抗原的效应T细胞的作用,恢复免疫耐受机制。 除了这种方法之外,Kasagi等人还可以用两种分别针对CD20 B细胞抗原和CD8 T细胞抗原的单克隆抗体(monoclonal antibodies)来取代全身γ射线照射方案。这些抗体与小鼠体内的免疫细胞结合之后会通过凋亡途径破坏这些免疫细胞。这样一来,就可以只破坏这些“无辜的”旁观者细胞,而保留下我们需要的吞噬细胞。这样就可以产生出足够的β转化生长因子,然后在外源注射的自身免疫抗原的刺激下,诱导自身免疫抗原特异性的Tregs细胞大量增殖。这种经过人工“重编程(reprogrammed)”的免疫系统还是可以对外来的细菌等病原微生物产生免疫反应,并不会破坏正常的免疫保护作用。 那么这些能够发挥治疗作用的自身免疫抗原特异性的Tregs细胞究竟是从何而来的呢?目前还不太清楚这些细胞究竟是否分化自来源于胸腺的独特的CD4 T细胞(FoxP3+Treg细胞)。这些细胞也有可能就是普通的外周CD4 T细胞,在自身免疫抗原和β转化生长因子的作用下形成的。我们也不太清楚这些自身免疫抗原特异性的Tregs细胞在体内能够维持多长时间,是否能够将机体的自身免疫耐受机制一直维持下去。 从更加实用的角度来看,用于治疗大多数自身免疫病的自身抗原是比较容易获得,而且非常安全的。而针对CD20抗原的单克隆抗体也是比较容易制备,同时也是非常安全的。不过针对CD8的单克隆抗体虽然经过了多年的开发,但目前还在研发之中。如果我们想将Kasagi等人开发的这种细胞疗法应用于临床,除了必须要解决的科学问题之外,同时还必须加强科研机构与企业之间的联系。这种细胞疗法除了可以用于治疗自身免疫病之外,在其它的很多领域都可以大有所为,比如移植免疫、基因疗法、再生医学等领域。 原文检索: Lucienne Chatenoud. Teaching the immune system "self" respect and tolerance. Science, 20 June 2014; DOI:10.1126/science.1256864 |
Science:重建机体的免疫耐受机制
时间:2014-07-04 11:17来源:生物360 作者:未知
顶一下
(0)
0%
踩一下
(0)
0%
------分隔线----------------------------
- 发表评论
-
- 最新评论 进入详细评论页>>
- 推荐内容
-
- 患有和不患有MS的妇女妊娠率和结局
近日,神经病学领域权威取杂志Neurology上发表了一篇研究文章,...
- 上海巴斯德所发现人体固有免疫系
11月21日,国际学术期刊JournalofHepatology在线发表了中国科学院上...
- 免疫治疗:未来值得关注的四大趋
2010年,美国FDA批准前列腺癌免疫治疗药sipuleucel-T用于临床,到现...
- 终止妊娠无痛不代表无害 年轻人存
原标题:终止妊娠无痛不代表无害 年轻人存在3类避孕误区 在大...
- 我武生物董事长回应默沙东舌下免
大智慧阿思达克通讯社4月23日讯,我武生物(300357.SZ)董事长胡...
- 武汉病毒所在T细胞的天然免疫性研
近来,中国科学院武汉病毒研究所唐宏课题组的系列研究表明,...
- 患有和不患有MS的妇女妊娠率和结局