|
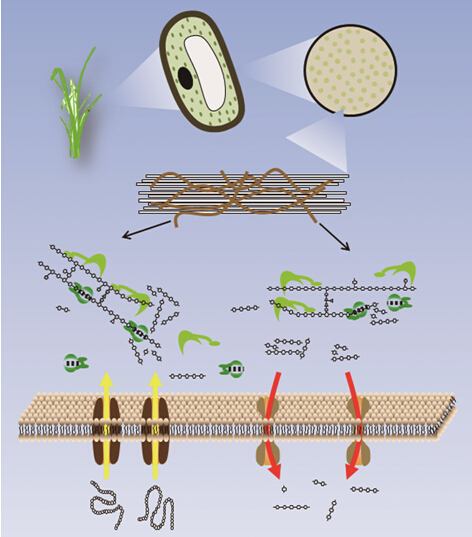
通常认为,CBMs(carbohydrate-binding modules,碳水化合物结合模块)与多糖底物结合,能通过定向效应与邻近效应提高酶的催化能力。研究人员已对CBMs开展了大量研究,但是其对糖苷水解酶催化特性和热稳定性影响,仍未有明确结论。
近日,中国科学院青岛生物能源与过程研究所微生物资源团队李福利研究员团队与山东大学王禄山教授团队合作,以来源于极端嗜热厌氧菌Caldicellulosiruptor sp. F32的糖苷水解酶(glycoside hydrolase,GH)11家族木聚糖酶和GH10家族木聚糖酶作为研究对象,系统分析了CBMs对木质纤维素酶热稳定性的影响,提出并丰富了多模块纤维素酶热适应性进化机制。相关成果于近日 在线发表在Appl Environ Microbiol(Meng, et al, Appl Environ Microbiol, 2015, 81(6): 2006-2014)。
研究发现,CBMs对木聚糖酶热稳定性具有决定性作用。GH11家族木聚糖酶CBMs缺失,导致蛋白质热稳定性提高,而GH10家族木聚糖酶CBMs缺失则降低酶的热稳定性。通过同源建模及等温滴定量热实验发现,木聚糖酶的耐热性不仅取决于单个模块的性质,还取决于蛋白质内的模块间相互作用;进一步通过化学交联法实验验证该推断,证明模块间是否存在相互作用决定了CBMs对木聚糖酶热稳定性的影响。
通过分析多个GH10和GH11家族木聚糖酶的Linker序列,发现GH11家族木聚糖酶linker具有高丝氨酸和苏氨酸含量,或脯氨酸含量。因此,linker具有强刚性,导致蛋白采取伸展构象,从而决定了GH11家族木聚糖酶不具有模块间相互作用。多模块糖苷水解酶热稳定性是氨基酸序列及模块间非共价相互作用共同进化的结果,蛋白质整体结构上的刚性和催化中心柔性之间的平衡,共同决定了酶的热稳定性。
上述研究获得了科技部973计划、国家自然科学基金等的支持。 (责任编辑:泉水) |
青岛能源所在糖苷水解酶热适应性进化机制研究取得新进展
时间:2015-03-04 15:34来源:青岛能源所 作者:未知 点击:
105次
顶一下
(0)
0%
踩一下
(0)
0%
------分隔线----------------------------
- 上一篇:中粮期货(年报):原油疲弱生物能源难有表现
- 下一篇:基于生物燃料电池的自供电传感器
- 发表评论
-
- 最新评论 进入详细评论页>>
- 推荐内容
-
- 青岛能源所在浮萍对重金属水污染
镉(Cadmium)是工业生产中重要的加工材料之一,也是世界八大污...
- 30万吨鸡粪 “换来”1.3亿度电 圣新
8月7日,在福建省圣新能源股份有限公司,技术人员正在对公司...
- 云南能源职业技术学院2016年公开招
云南能源职业技术学院2016年公开招聘8名工作人员公告,招聘岗...
- “十三五”期间 生物质能源大有可
2015年11月3日,《中共中央关于制定国民经济和社会发展第十三个...
- 蓝藻光合作用中捕获电能 微光合动
据最新一期《技术》杂志报道,加拿大研究人员发现并设计出一...
- 拉美注重以新能源提供发展动力 生
为了实现联合国千年发展目标,拉美地区经济需要稳定,需要增...
- 青岛能源所在浮萍对重金属水污染