|
有些药在体内转化为活性产物则需注意此活性产物的药动学,如果活性产物的消除是药物消除的限速步骤的话,则应按该产物的药动学参数计算剂量及设计给药方案。 四、一级药动学指标间的相互关系 1.F=A/D×100%口服剂量(D)由于不能100%吸收及存在首关消除效应,能进入体循环的药量(A)只占D的一部分,这就是生物利用度(F)。药动学计算时应采用绝对生物利用度,相对生物利用度作为评比药物制剂质量的指标。生物利用度还包括吸收速度问题,达峰时间(Tpeak)是一个参考指标。 2.A=C·Vd或C=A/Vd体内药量(A)与血药浓度(C)比值固定,在许多药动学公式中,A与C可以通用,如At=也可用Ct=。 3.Cp=[D]+[DP] 血浆中药物有游离型(D)与血浆蛋白结合型(DP),定量测定时需将血浆蛋白沉淀除去,故通常所说的血浆药物浓度(Cp)是指[D]与[DP]的总和。只有透析法或超离心法才可能将二者分离以计算药物的血浆蛋白结合率 4. 5.ke=0.693/t1/2=RE/A=CL/Vd 消除速率常数是药物瞬时消除的百分率而不是单位时间药物消除速率(RE),是决定t1/2的参数,但其本身又取决于Cl及Vd,故不是独立的药动学指标。 6.Vd=A/C0=A/AUC ke 表现分布容积(Vd)是独立的药动学指标,不是实际的体液容积,取决于药物在体液的分布。Vd大的药物与组织蛋白结合多,主要分布于细胞内液及组织间液。Vd小的药物与血浆蛋白结合多,较集中于血浆。Vd不因A多少而变化。 7.CL=keVd=RE/Cp=A/AUC 血浆清除率(Cl)是肝肾等清除率的总和,也不是实际的药物消除速率(RE),是另一个独立于A的重要药动学指标,但受肝肾功能的影响。 8.t1/2=0.693/ke=0.693Vd/CL 血浆药物消除半衰期(t1/2)是一个非常实用的药动学指标,虽然独立于A,但受Cl及Vd双重制约,Cl大时t1/2短,Vd大时t1/2长。例如庆大霉素Cl小(60ml·min-1),Vd也小(0.25L·kg-1),其t1/2不长(2~3h)。氯喹Cl大(700ml·min-1),Vd也大(185L·kg-1),其t1/2并不短(8天)。药物在吸收及分布过程中也有半衰期,分别用t1/2a及t1/2α表示。 9.稳态时RA=RE=CSS·Cl=CSS·Vd·ke 故 10. 11. 五、房室模型 以上所述各种药动学公式都是将机体视为一个整体空间,假设药物在其中转运迅速,瞬时达到分布平衡的条件下推导而得的。实际上机体绝非如此简单,不仅有血浆、细胞外液及细胞内液等间隔,而且各组织细胞间存在着无数的区间。静脉注射药物的时量(对数标尺)关系并非直线,而是一条由无数区段组成的连续弧线。粗略地看可见早期一段快速下降,后来才逐渐稳定缓慢下降。这是因为药物进入血液循环后快速向组织分布,首先进入血注量大的肺、肾、心、脑等器官,然后再向其他组织分布,最后达到平衡(假平衡)。因此设想机体由几个互相连通的房室(compartment)组成。这个房室不是解剖学上分隔体液的房室,而是按药物分布速度以数学方法划分的药动学概念。多数药物按二房室模型转运(少数单房室或多房室),中央室大致包括血浆及那些血流量多的器官,周边室包括机体其余部分,界限并不明确。时量曲线因此也只能大致分为分布相及消除相两个指数衰减区段(图3-10)。其药动学规律与单房室不同,如C=Ae-αt +Be-βt,α及β分别为分布相(A)及消除相(B)的消除速率常数。而且在分布相中Vd逐渐增大,ke(α)逐渐减少,t1/2逐渐延长,因此药动学计算需要特殊处理。即使在消除相,血药浓度稳定线性下降,各组织浓度及其下降速度也不尽相等,故称假平衡。可见问题非常复杂。
图3-10 二房室模型时量曲线 正由于问题过于复杂,临床应用诸多不便,实际运算也存在诸多困难。房室模型并非药物固有的药动学指标,机体也无此解剖学间隔,即使运用电子计算机拟合也不一定获得明确的划分。用同一药物试验,在某些人呈二室模型,另些人可能呈一室或三室模型。同一药物静脉注射时呈二室模型而口服则呈单一房室模型。在分布相时药物实际上已开始消除,到达消除相时可能已有相当分量的药物已被消除。如果用血管外给药(口服、肌注等)分布相常被吸收相掩盖。这些时相的划分仅靠血药浓度的测定。如果早期(此时血药浓度变化较快)取样间隔过疏,很难据此准确划分时相,因此,越来越多的临床家及研究者逐渐放弃房室模型而转向采用适用于所有药物的无房室方法(noncompartmental medtod)来解决实际问题,对此,有待今后深入学习。 从另一方面看,时量曲线在达到假平衡后已呈单一指数衰减的直线,此时房室划分已无需要,可以按β值计算t1/2及其他实用的药动学指标。 AUC是与房室无关的药动学指标,可用实验方法测定。AUC(0-∞)=C0/ke,或AUC(T-∞)=CT/β,T是消除相开始的时间。再用AUC算出Vd及Cl: Vd=A/AUCβ,CL=A/AUC (中山医科大学 孙家钧) (责任编辑:泉水) |
第三节 药物消除动力学(2)
时间:2006-06-19 20:43来源:大众医药网 作者:admin 点击:
569次
顶一下
(12)
100%
踩一下
(0)
0%
------分隔线----------------------------
- 发表评论
-
- 最新评论 进入详细评论页>>
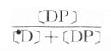 ×100% 。
×100% 。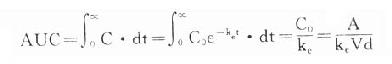 曲线下面积(AUC)是一个可用实验方法测定的药动学指标。它反映进入体循环药量的多少。时量曲线某一时间区段下的AUC反映该时间内的体内药量。AUC是独立于房室模型的药动学参数,常用于估算血浆清除率(Cl)。
曲线下面积(AUC)是一个可用实验方法测定的药动学指标。它反映进入体循环药量的多少。时量曲线某一时间区段下的AUC反映该时间内的体内药量。AUC是独立于房室模型的药动学参数,常用于估算血浆清除率(Cl)。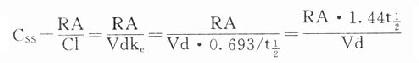 CSS是恒速连续给药达到稳态时平均血药浓度,应该和预期的有效浓度相等。必要时可以按达到的CSS与预期的CSS比值调整剂量或给药速度(RA)。
CSS是恒速连续给药达到稳态时平均血药浓度,应该和预期的有效浓度相等。必要时可以按达到的CSS与预期的CSS比值调整剂量或给药速度(RA)。 分次定时定量给药时,CSS上下波动。当每t1/2给药一次时,其峰值(CSS- max)与谷值(CSS- min)的比值为2,缩短给药间隔可以减少CSS波动。
分次定时定量给药时,CSS上下波动。当每t1/2给药一次时,其峰值(CSS- max)与谷值(CSS- min)的比值为2,缩短给药间隔可以减少CSS波动。 每t1/2给药一次时,首次给予加倍剂量,即负荷剂量(D1)可以立即达到CSS。
每t1/2给药一次时,首次给予加倍剂量,即负荷剂量(D1)可以立即达到CSS。