|
第十六章 羧酸及其衍生物 羧酸(RCOOH)是最重要的一类有机酸。它可以看作是烃分子中的氢原子被羧基( 第一节 羧酸 羧酸在自然界中常以游离状态或以盐或酯的形式广泛存在于动植物体中,是与医药关系十分密切的一类化合物。 一、羧酸的分类及命名 按照烃基构造的不同,羧酸可分为脂肪族羧酸(饱和及不饱和的)、脂环族羧酸和芳香族羧酸。根据羧酸分子中所含羧基的数目,又可分为一元酸及多元酸。链状的一元羧酸(包括饱和的及不饱和的)通称为脂肪酸。羧酸的分类见表16-1。 表16-1 羧酸的分类 脂肪族羧酸 饱和羧酸 一元羧酸 二元羧酸 CH2COOH HOOC-COOH 乙酸(醋酸) 乙二酸(草酸) 不饱合羧酸 CH2=CH-COOH HOOCCH=CHCOOH 丙烯酸 丁烯二酸 脂 环 族 羧 酸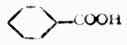
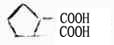 环已烷羧酸
1,2-环戊烷二羧酸
芳香族羧酸
环已烷羧酸
1,2-环戊烷二羧酸
芳香族羧酸
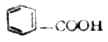
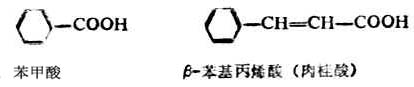
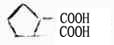 苯甲酸
邻苯二甲酸
苯甲酸
邻苯二甲酸
许多羧酸可以从天然产物中获得,因此它们常根据最初的来源而有俗名,如蚁酸、醋酸、草酸等。羧酸的系统命名法与醛相似。饱和脂肪酸命名是以包括羧基碳原子在内的最长碳链作为主链,根据主链碳原子数称为某酸,从羧基碳原子开始编号。例如:
不饱和脂肪酸命名时,主链应是包括羧基碳原子和各碳碳重键的碳原子都在内的最长碳链,从羧基碳原子开始编号,并注明重键的位置。例如:
二元酸的命名是以包括两个羧基碳原子在内的最长碳链作为主链,按主链的碳原子数称为“某二酸”。例如;
二、羧酸的物理性质 低级饱和脂肪酸(甲酸、乙酸、丙酸)是具有强烈刺激性气味的液体;中级的(C4-C9)羧酸是带有不愉快气味的油状液体;C10及C10以上的羧酸为无味的油状固体,挥发性很低,脂肪族二元羧酸和芳香族羧酸都是固体。 低级脂肪酸易溶于水,但随着相对分子质量的增加,在水中的溶解度减小,以至难溶或不溶于水,而溶于有机溶剂。 羧酸的沸点比相对分子质量相近的醇还要高。例如,甲酸和乙醇的相对分子质量相同,但乙醇的沸点为78.5℃,而甲酸为100.5℃。这是因为羧酸分子间能以氢键缔合成二聚体,羧酸分子间的这种氢键比醇分子间的更稳定。例如,乙醇分子间的氢键键能为25.94kJ·mol-1,而甲酸分子间的氢键键能则是30.12kJ·mol-1。低级羧酸即使在气态也是以二缔合体的形式存在。
表16-2 一些羧酸的物理常数和pKa 名称 构造式 熔点/℃ 沸点/℃ 溶解度 g·(100g水)-1
PKa (25℃)pKa1 ,pKa2
甲酸
HCOOH
8.4
100.5
∞
3.77
乙酸
CH3COOH
16.6
118
∞
4.76
丙酸
CH3CH2COOH
-22
141
∞
4.88
正丁酸
CH3CH2CH2COOH
-4.7
162.5
∞
4.82
正戊酸
CH3(CH2)3COOH
-35
187
3.7
4.81
正己酸
CH3(CH2)4COOH
-1.5
205
0.4
4.84
正庚酸
CH3(CH2)5COOH
-11
223.5
0.24
4.89
正辛酸
CH3(CH2)6COOH
16.5
237
0.25
4.85
壬酸
CH3(CH2)7COOH
12.5
254
4.96
癸酸
CH3(CH2)8COOH
31.5
268
软脂酸
CH3(CH2)14COOH
62.9
269(13Pa)
硬脂酸
CH3(CH2)10COOH
69.6
287(13Pa)
丙烯酸
CH2=CHCOOH
13
141
4.26
乙二酸
HOOC-COOH
189
8.6
1.46 4.40
己二酸
HOOC(CH2)4COOH
151
276
1.5
4.43 5.52
顺丁烯二酸
三、羧酸的化学性质 羧酸是由羧基和烃基组成的,羧基包括羰基和羟基两个部分,因而不同程度地反映了羰基和羟基的某些性质。但羧基的性质并非两个基团的简单加和,由于羰基和羟基的相互影响表现出许多新的性质。 用物理方法测定甲酸中C=O键长为0.1245nm,比普通羰基的键长(0.122nm)略长一点;C-OH键中的碳氧键长为0.131nm,比醇中的键长(0.143nm)短得多。这表明羧酸中羰基与羟基间发生了相互影响。 在羧酸分子中,羰基碳原子的三个sp2杂化轨道一个与氧成键,一个与羟基氧成键,另一个与氢或烃基成键,这三个轨道在一个平面上,键角约120°;碳原子上的一个未参与杂化的p轨道与氧原子的p轨道构成了π键。但羧基中-OH氧上有一对未共用的电子,可与π键形成p-π共轭体系。
这样一来,一方面使 经X射对甲酸根离子的测定表明,它的两个碳氧键的键长都是0.127 nm 。这说明氢以质子形式脱离羧基后,p-π共轭作用更完全,发生了键的平均化。这样,-COO-上的负电荷不再集中于一个氧原子,而是平均分配在两个氧上,所以羧酸根离子更稳定.
(一)酸性 羧酸在水中可离解出质子而显酸性,其pKa值一般为4-5,属于弱酸。
2RCOOH+Na2CO3→2RCOONa+CO2↑+H2o RCOOH+NaHCO3→RCOONa+CO2↑+H2o 利用羧酸与碳酸氢钠的反应可将羧酸与酚类相区别。因羧酸可溶于碳酸氢钠溶液并放出二氧化碳,而一般酚类与碳酸氢钠不起作用。 低级和中级羧酸的钾盐、钠盐及铵盐溶于水,故一些含羧基的的药物制成羧酸盐以增加其在水中的溶解度,便于做成水剂或注射剂使用,。 在羧酸(RCOOH)分子中,与羧基直接或间接直连的原子团对羧酸的酸性有不同程度的影响(表16-3)。 表16-3 一些羧酸的电离常数
化合物 构造式 PKa 1.甲酸 HCOOH 3.77 2.乙酸 CH3COOH 4.76 3.氯乙酸 ClCH2COOH 2.86 4.二氯乙酸 Cl2CHCOOH 1.29 5.三氯乙酸 Cl3CCOOH 0.65 6.溴乙酸 BrCH2COOH 2.90 7.碘乙酸 ICH2COOH 3.18 8.氟乙酸 FCH2COOH 2.66 9.三氟乙酸 F3CCOOH 强酸 10.丁酸 CH3CH2CH2COOH 4.82 11.α-氯丁酸
|
第十六章 羧酸及其衍生物- -第一节 羧酸
时间:2006-07-01 21:42来源:大众医药网 作者:admin 点击:
750次
顶一下
(7)
100%
踩一下
(0)
0%
------分隔线----------------------------
- 发表评论
-
- 最新评论 进入详细评论页>>
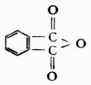 或写为-COOH)取代后生成的化合物,羧基是羧酸的官能团。羧酸能发生许多化学反应。当羧基中的羟基被其它原子团取代时,则形成羧酸衍生物,主要有羧酸酯、酰卤,酸酐和酰胺。
或写为-COOH)取代后生成的化合物,羧基是羧酸的官能团。羧酸能发生许多化学反应。当羧基中的羟基被其它原子团取代时,则形成羧酸衍生物,主要有羧酸酯、酰卤,酸酐和酰胺。
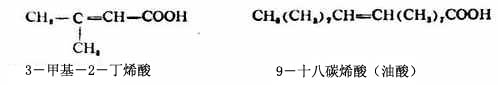
 羧基直接连在脂环上的羧酸命名时,可在脂环烃的名称后加上“羧酸或二羧酸”等词尾;羧基在脂环上的羧酸命名是将脂环烃的名称与脂肪酸的名称连接起来。另外,不论羧基直接连在脂环上还是连在脂环侧链上,均可把脂环作为取代基来命名。例如;
羧基直接连在脂环上的羧酸命名时,可在脂环烃的名称后加上“羧酸或二羧酸”等词尾;羧基在脂环上的羧酸命名是将脂环烃的名称与脂肪酸的名称连接起来。另外,不论羧基直接连在脂环上还是连在脂环侧链上,均可把脂环作为取代基来命名。例如;
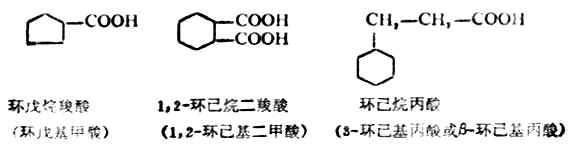 芳香酸可将其作为脂肪酸的芳香基取代物来命名。例如:
芳香酸可将其作为脂肪酸的芳香基取代物来命名。例如:
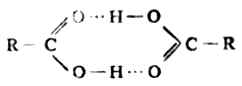
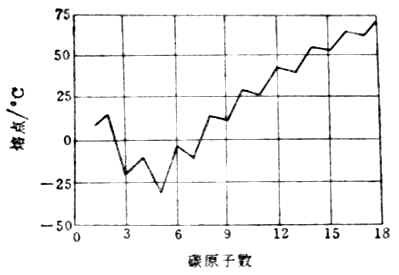 饱和脂肪酸熔点随着分子中碳原子数的增加呈锯齿形变化(图16-1)。含偶数碳原子的羧酸其熔点比其相邻的两个含奇数碳原子羧酸分子的熔点高。这可能是由于偶数碳原子羧酸分子较为对称,在晶体中排列更紧密的缘故。一些羧酸的物理常数和pKa值见表16-2。
饱和脂肪酸熔点随着分子中碳原子数的增加呈锯齿形变化(图16-1)。含偶数碳原子的羧酸其熔点比其相邻的两个含奇数碳原子羧酸分子的熔点高。这可能是由于偶数碳原子羧酸分子较为对称,在晶体中排列更紧密的缘故。一些羧酸的物理常数和pKa值见表16-2。
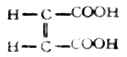 131
易溶
1.92 6.59
反丁烯二酸
131
易溶
1.92 6.59
反丁烯二酸
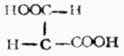 287
0.7
3.03 4.54
苯甲 酸
C6H5COOH
122
249
0.34
4.19
苯乙酸
C6H5CH2COOH
78
265
1.66
4.28
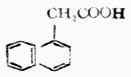
萘乙酸
287
0.7
3.03 4.54
苯甲 酸
C6H5COOH
122
249
0.34
4.19
苯乙酸
C6H5CH2COOH
78
265
1.66
4.28
萘乙酸
 131
0.04
131
0.04
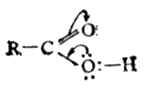
 原子团失去了典型的羰基性质,另一方面-OH氧原子的电子云向羰基移动,氧的电子云密度降低,有利于氢的离解,故羧酸的酸性强于醇。
原子团失去了典型的羰基性质,另一方面-OH氧原子的电子云向羰基移动,氧的电子云密度降低,有利于氢的离解,故羧酸的酸性强于醇。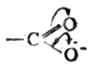 根据羧酸的构造,它可以发生如下反应。
根据羧酸的构造,它可以发生如下反应。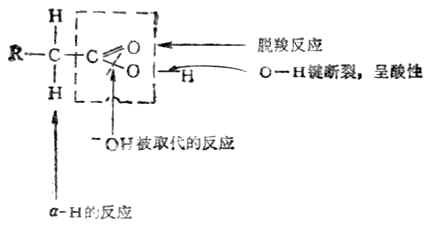
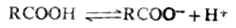 羧酸的酸性虽比盐酸,硫酸等无机酸弱得多,但比碳酸(pKa=6.35)和一般的酚类(pKa-10)强。故羧酸能分解碳酸盐和碳酸氢盐,放出二氧化碳。
羧酸的酸性虽比盐酸,硫酸等无机酸弱得多,但比碳酸(pKa=6.35)和一般的酚类(pKa-10)强。故羧酸能分解碳酸盐和碳酸氢盐,放出二氧化碳。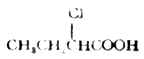 (责任编辑:泉水)
(责任编辑:泉水)