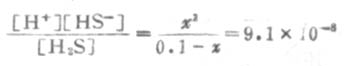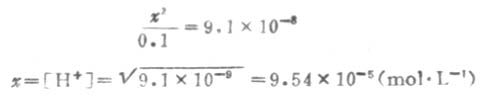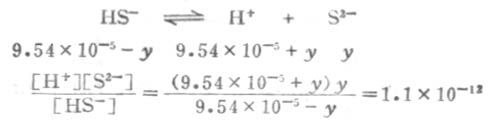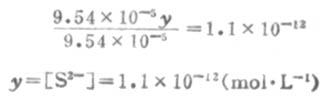|
第二章 电解质溶液 电解质分为强电解质和弱电解质.强电解质在水溶液中全部离解或近乎全部离解.而弱电解质在水溶液中只有一小部分离解。这两类电解质溶液的性质有较大差别。 电解质在水溶液中离解出来的离子全部都是水化的,但由于参加水化的水分子数目并不固定,所以在书写时仍以简单离子的符号表示,如H+、Na+、OH-离子等。 电解质在化学和生产上经常遇到,与人体亦关系密切,它常以一定浓度的离子形式广泛存在于人的体液和组织液中,其含量关系到人体的生理工能。因此,研究电解质溶液的有关性质,对医科学生来说很有必要。 第一节 电解质在溶液中的离解 一、一元弱酸弱碱的离解平衡 (一)离解度和离解常数 一元弱酸弱碱(如HOAc,NH3等)是弱电解质,在溶液中只能部分离解。离解程度用离解度表示。 离解度是指溶液中已经离解的电解质的分子数占电解质总分子数(已离解的和未离解的)的百分数。通常用α表示。
一元弱酸HA存在以下的离解平衡:
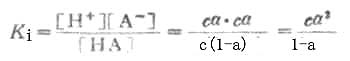
平衡浓度为 c(1-α) cα cα其中c为HA的总浓度,α为离解度。 离解常数KI可表示为
KI在一定温度下为一常数,不能随浓度变化而变化。弱酸的离解常数习惯上用Ka表示,弱碱的离解常数用Kb表示。 如果弱电解质离解度α很少,则 1-α≈1 这时式(2-1)为
从式(2-2)可以看出,在一定温度下,同一弱电解质的离解度大约与溶液浓度的平方根成反比,即离解度随溶液的稀释而升高。这条说明溶液浓度与离解度关系的定律,叫做稀释定律。式(2-2)叫做稀释定律公式。利用此公式可以进行有关离解试或离解常数的计算。 例1在25℃时,已知(1)0.1mol·L-1HOAc的离解度为1.32%;(2)0.2mol·L-1HOAc的离解度为0.93%,求HOAc的离解常数。 解:(1) (2) 从例1可以看出,对不同浓度HOAc溶液,在一定温度下,所计算出来的离解常数基本是一致的。表2-1是HOAc溶液在25℃时,不同浓度的离解度以及由离解度计算出来的离解常数值。 表2-1 25℃,不同浓度醋酸的离解度和离解常数 浓度/mol·L-1 离解度/% 离解常数 0.001 12.4 1.76×10-5 0.01 4.1 1.76×10-5 0.02 2.96 1.80×10-5 0.1 1.32 1.76×10-5 0.2 0.93 1.76×10-5利用离解常数可以计算一定浓度某弱酸溶液中的H+浓度,或计算弱碱溶液中的OH-=浓度。
式中HA为弱酸,BOH为弱碱。 在浓度为c的弱酸中,[H+]=cα,即α=[H+]/c,又根据稀释定律,
同理,在浓度为c的弱碱溶液中,
根据式(2-3)和式(2-4),可以计算一定浓度的弱酸或弱碱的[H+]或[OH-]。 离解常数的大小用以衡量酸或碱的强弱程度。酸或碱越弱,它们的离解常数值就越小。一般认为KI在10-5至10-9范围内的电解质是弱电解质;KI值小于10-10时是极弱电解质。 (二)影响离解平衡的因素 弱酸和弱碱的离解平衡都是暂时的、相对的动态平衡。当外界条件改变时,离解平衡像其它平衡一样,会发生移动,结果弱酸和弱碱的离解程度都有所增减。因此,可以应用平衡移动原理,通过改变外界条件,控制弱酸和弱碱的离解程度。外界条件主要指温度,同离子效应和盐效应的影响。 1.温度的影响 温度变化能使离解平衡发生移动,这种移动是通过离解常数的改变实现的,但在常温范围内变化不大。 2.同离子效应 离子浓度的改变,对弱酸和弱碱离解程度的影响极为显著。 例如,在醋酸溶液中加入一些醋酸钠,由于醋酸钠是强电解质,在水溶液中完全离解Na+OAc-,这样溶液中[OAc-]增大,使 离解平衡向左移动,从而降低了醋酸的离解度和溶液中的H+浓度。
由此可以得出结论,在弱电解质溶液中,加入与弱电解质具有相同离子的强电解质,使弱电解质的离解度降低的效应,称为同离子效应。 3.盐效应 在弱电解质溶液中,加入与弱电解质没有相同离子的强电解质,而使弱电解质的离解度略微增大的效应,称为盐效应。 盐效应的产生,是由于强电解质的加入,使溶液中离子间的相互牵制作用增强,离子结合成分子的机会减少,降低了分子化的程度,因而达到平衡时,弱电解质的离解度比未加入强电解质时略微大些。 例如,在0.1mol·L-1HOAc溶液中加入NaCL晶体,使NaCL的浓度为0.1mol·L-1时,[H+]不是1.32×10-3mol·L-1,而是1.70×10-3mol·L-1,离解度不是1.32%而是1.70%. 应该指出,在发生同离子效应的同时,必然伴随着盐效应的发生.这两个效应对弱电解质离解度影响不同.盐效应可以使弱电解质的离解度增大一些,而同离子效应可以使弱电解质的离解度大大降低.这说明同离子效应和盐效应对溶液酸碱性的影响是不能相提并论的.因此,对稀溶液来说,如不考虑盐效应,是不会引起很大误差的. 二、多元酸碱在溶液中的离解 多元酸碱在溶液中的离解是分步进行的,叫做分步离解。表2-2列出了一些常见的多元酸的分步离解常数。表中pKa为Ka的负对数值。 表2-2 一些常见的多元酸的分步离解常数 名称 分子式 Ka1 PKa1 Ka2 PKa2 Ka3 PKa3 酸性强度增加 草酸 H2C2O4 5.4×10-2 1.27 5.4×10-5 4.27 2.2×10-13 12.67 亚硫酸 H2SO3 1.54×10-2 1.81 1.02×10-7 6.91 磷酸 H3PO4 7.52×10-3 2.12 6.23×10-8 7.21 丙二酸 CH2(COOH)2 1.38×10-3 2.86 2×10-6 5.70 邻苯二甲酸 C6H4(COOH)2 1.12×10-3 2.95 3.9×10-5 5.41 酒石酸 (CHOHCOOH)2 9.1×10-4 3.04 4.3×10-5 4.37 碳酸 H2CO3 4.30×10-7 6.37 5.61×10-11 10.25 氢硫酸 H2S 9.1×10-8 7.04 1.1×10-12 11.96例如草酸(H2C2O4)的离解分两步进行。 一级离解
二级离解
磷酸的离解要分三步,有Ka1、Ka2、和Ka3三个离解常数,且Ka1》Ka2》Ka3。这说明多元酸分级离解是依次变难。 根据多元酸的浓度和各级离解常数,可以算出溶液中各种离子的浓度。 例2 计算0.1mol·L-1H2S溶液中的H+和S2-的浓度。 解:由于H2S的 Ka1》Ka2 ,所以H2S溶液中的H+主要来自第一步离解,而第一步离解所产生的H+,又抑制第二步离解。这样计算H2S溶液中H+的总浓度时,可以忽略第二步离解的H+,近似地等于第一步离解平衡时H+浓度。 设第一步离解平衡时[H+]=x,则[H+]≈[HS-],平衡时则有下列关系:
因Ka1很小,x必然很小,所以0.1-x≈0.1,则
溶液中的S2-是第二步离解的产生,因此,计算溶液中的S2-浓度时,应根据第二步离解平衡进行计算. 设第二步离解时,[S2-]=y,平衡时有下列关系: 因为Ka1极小,y必然极小,所以9.54×10-5±y≈9.54×10-5,则
所以,[S2-]≈Ka2。 三、强电解质在溶液中的离解 (一)离子互吸学说 稀释定律适用于弱电解质溶液,而不适用于强电解质溶液。为了阐明强电解质在溶液中的实际情况,德拜(Debye)和休克尔(Huckel)提出了离子互吸学说,又叫完全电离学说。这种学说认为,强电解质在水溶液中完全离解成离子,离子在水溶液中并不完全自由。带异号电荷的离子相互吸引,距离近的吸引力大;带同号电荷的离子相互排斥,距离近的排斥力大。因此,离阳离子越近的地方,阳离子越少,阴离子越多;离阴离子越近的地方,阴离子越少,阳离子越多。总的结果是,任何一个离子都好像被一层球形对称的异号电荷离子所包围着。这层在中心阳离子周围所构成的球体,叫做离子氛。如图2-1所示,位于球体中心的离子称为中心离子,在中心阳离子周围有阴离子氛,在中心阴离子周围有阳离子氛。 (责任编辑:泉水) |
第二章 电解质溶液- -第一节 电解质在溶液中的离解
时间:2006-07-01 21:44来源:大众医药网 作者:admin 点击:
558次
顶一下
(16)
100%
踩一下
(0)
0%
------分隔线----------------------------
- 上一篇:第二节 酸碱质子理论
- 下一篇:第三节 溶液的渗透压
- 发表评论
-
- 最新评论 进入详细评论页>>

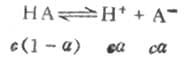
 (2-1)
(2-1)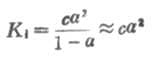
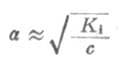 (2-2)
(2-2)

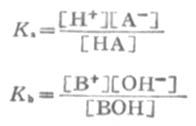
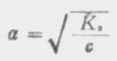 , 则
, 则 (2-3)
(2-3)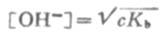 (2-4)
(2-4)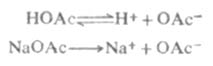 又如,在氨水中加入一些氯化铵,由于氯化铵是强电解质,在水溶液中完全离解成NH4+和CL-,这样溶液中[NH4+]增大,使离解平衡向左移动,从而降低了氨水的离解度和溶液中的OH-浓度。
又如,在氨水中加入一些氯化铵,由于氯化铵是强电解质,在水溶液中完全离解成NH4+和CL-,这样溶液中[NH4+]增大,使离解平衡向左移动,从而降低了氨水的离解度和溶液中的OH-浓度。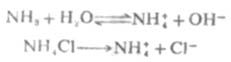
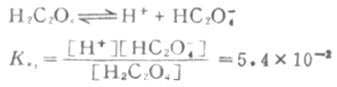
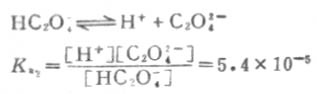 二级离解总比一级离解困难,因为H+要克服带有两个电荷的C2O2-4对它的吸引。从Ka1和Ka2可以反映这一点。草酸溶液中的HC2O-4浓度要比C2O2-4浓度大得多。
二级离解总比一级离解困难,因为H+要克服带有两个电荷的C2O2-4对它的吸引。从Ka1和Ka2可以反映这一点。草酸溶液中的HC2O-4浓度要比C2O2-4浓度大得多。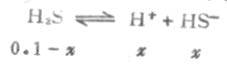 由表2-2知H2S的Ka为9.1×10-8,则
由表2-2知H2S的Ka为9.1×10-8,则