|
核糖核酸干扰技术
转录后基因沉默(PTGS, post- transcriptional gene silencing)-最初被认为仅限于矮牵牛花和其它一些植物中的奇异现象,是目前分子生物学研究中一个最热门的话题。过去几年中,科研工作者已明确转录后基因沉默现象普遍存在于动、植物中,在机体防御病毒入侵和转座子沉默效应中起着重要作用。但是最激动人心的是转录后基因沉默现象的技术应用,即在多种有机体中应用核糖核酸干扰(RNA interfere ,RNAi)技术进行特异性的基因剔除以研究相应的基因功能。那么核糖核酸干扰现象是如何被发现?它是怎样工作的?科研工作者怎样把它应用到功能基因组学的研究中呢?
10多年前,Rich Jorgensan和他的同事在矮牵牛花中发现一种奇怪的现象。他们尝试把由一强有力启动子控制的基因pigment-produing导入矮牵牛花以加深花的紫色,结果不但颜色未加深,许多花呈现杂色甚至白色。Rich Jorgensan把这种现象称为"共抑制",因为外源性导入基因和内源性具有相似功能基因的表达都被抑制了。当时人们不知道这是一种转录后基因沉默。
双链核糖核酸能导致转录后基因沉默首先来自于对线虫的研究。1995年Guo和Kewphues试图用反义核糖核酸来阻断Par-1基因的表达以研究其功能。确实反义核糖核酸抑制了基因表达,出乎意料的是用作阴性对照的正义核糖核酸也抑制了基因表达。该结果一直让人迷惑不解,直至三年后Fire和Mello进行了另一实验才真正提出双链核糖核酸能导致转录后基因沉默的理论。Fire和Mello发现把反义核糖核酸和正义核糖核酸的混合物导入线虫后,其抑制效应远远强于单独导入反义核糖核酸或正义核糖核酸的抑制效应。再后来Baulcomb和Hamilton首先发现是~25nt的核糖核酸能特异性抑制具有相应互补序列的基因表达。
那么核糖核酸干扰(RNAi)是怎样工作的呢?首先外源导入的双链核糖核酸(dsRNA)被切割为21~23nt的小分子干扰核糖核酸(siRNA)。Dicer, 作为特异性核糖核酸酶家族的一个成员,切割双链核糖核酸为19~23nt小分子干扰核糖核酸(siRNA),这是一个依赖ATP的耗能过程. 切割后的 siRNA具有3'两个核苷酸TT突出末端。然后siRNA结合到核糖核酸酶复合物上形成RNA诱导的基因沉默复合体(RISC,RNA-induced silencing complex)。该复合体依赖ATP释能而解聚siRNA双链成单链以激活RISC。活化的RISC通过由siRNA决定的碱基互补配对原理切割具有同源序列的基因转录体,最终导致基因沉默效应。目前具体的切割机制还不明了,研究表明每个RISC包括单链siRNA和核糖核酸酶RNase。.
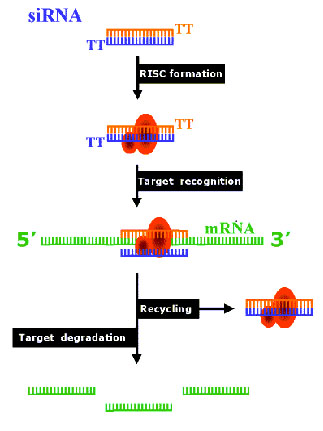 |
由于RNAi强大的基因沉默效应,有人提出了RNAi通路的效应扩增问题。RNAi通路的效应扩增可能是通过细胞复制外源导入的dsRNA或siRNA本身而实现的。另外,RISC的多次反复使用也能扩增RNAi的基因沉默效应。
科研工作者已开始RNAi效应增强子和效应抑制子的研究,认为RNAi是机体细胞一种强有力的基因调控机制。但是在哺乳细胞中外源导入大分子dsRNA(>30nt)常常导致非特异性的基因沉默效应,因为它激活了核糖核酸酶RNaseL而导致非特异性的RNA降解。相反,siRNA(<30nt)不激活RNaseL,而是通过序列特异性的方式诱导基因沉默效应。该序列特异性方式非常严格,一个碱基的错配会显著降低基因沉默效应。所以siRNA可以解释如下,它是一种具有3'两个核苷酸TT突出末端的21~23nt大小的双链核糖核酸,作为RNAi的中介分子,通过序列互补配对法则特异性降解目的基因。
siRNA可以经化学合成,比如著名生物学公司Proligo、Orbigen在siRNA合成方面处于世界领先水平,它们既提供即用型siRNA,也提供标记生物素、荧光素和磷酸等的siRNA更方便监测其抑制特异基因表达的效果
siRNA也可以通过体外转录获取。它相对便宜,尤其适合于同时合成多个siRNA。虽然理论上说,任何一个具有3'两个核苷酸TT突出末端的19~23nt小分子干扰核糖核酸 siRNA都具备序列特异性的基因沉默效应,但是由于位置效应,比如某些序列,尤其是调控序列易被蛋白质附着而阻止RISC的抑制效应,所以科研工作者首先合成2~4个siRNA进行预实验以选定作用最佳者。RNA专家Ambion公司提供通过体外转录获取siRNA的商品化试剂盒,使这一选择过程简单方便。
目前外源注射和转染是转运siRNA到细胞或机体的主要途经,之后基因沉默效应可以持续数天,同时传至下一代细胞,但终将短时间内消失,因此,最近许多科研小组开发了siRNA的表达质粒,通过瞬时转染或稳定转染以达到在细胞内不断表达siRNA的目的。有些质粒是表达小发夹结构RNAs(shRNAs, small hairpin RNAs), 在细胞内它被加工处理为siRNA样分子,诱导基因沉默。该质粒是在polyMeraseⅢ启动子和4~5个碱基T转录终止信号中插入shRAN。由于polyMeraseⅢ的特性,转录常常在第二个T终止,插入序列折叠成step-loop结构并带有3'-UU突出末端。该质粒设计是基于线虫、果蝇等中的实验结果,因为其中的基因沉默效应就是通过step-loop而诱导。另外一种siRNA表达质粒是把编码正义和反义的siRNA分别受控于各自的polyMeraseⅢ启动子。两种质粒的基因沉默效应相当。Invivogen公司和Imgenex公司都有操作简单、作用有效的商品化试剂盒提供。而Gene Therapy System 公司的siRNA构建试剂盒则完全采用了不同的机制。该试剂盒首先PCR合成目标序列,然后由T7RNA多聚酶进行体外转录,经退火和纯化处理的体外转录dsRNA模板被重组的Dicer酶切割,从而快速、高效地产生大量小分子干扰RNA(siRNAs)。产生的siRNAs混合物,比单一形式的siRNA更可能导致基因表达沉默。
基于目前的发表文献和一些实验经验,siRNA的设计可遵循以下几点进行1)选择以碱基A或G开始的19~21nt大小的目的mRNA。因为RNA polyMeraseⅢ启动子只有在第一个转录碱基是嘌呤时才能有效作用。2)针对目的mRNA一般选择2~4个不同序列,GC含量为30~50%,避免四个碱基T或A的连续序列,避免选择起始密码下游50~100nt、终止密码上游100nt以及5'和3'的非编码区域,BLAST检查设计序列的特异性。3)设计适当的实验对照,比如设计有1~2个碱基错配的序列,或者是随机变更siRNA的碱基排列顺序。
RNAi的研究刮起了科学界的风暴,siRNA迅速有效抑制特异基因功能的性质促使科研工作者不断深入完善该领域的研究。RNAi可能是未来发展基因治疗策略的新希望所在。RNAi技术必将带来功能基因组学的革命。
(责任编辑:泉水) |

