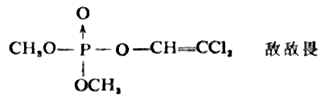第十四章 醇、酚、醚- -第一节 醇
时间:2006-07-01 21:42 来源:大众医药网 作者:admin 点击:次
|
第十四章 醇、酚、醚 醇、酚和醚都是烃含氧衍生物。 醇一般可看作是烃分子中的氢原子被羟基(-OH)取代的化合物。羟基是醇的官能团。但芳香烃苯环上的氢原子羟基取代的化合物不属于醇而属于酚。酚的官能团也是羟基。 R-h 烃R-OH 醇 Ar-H 芳香烃Ar-OH 酚 醇和酚分子中虽然都含有相同的官能团,但酚中的羟基仅限于直接连在芳香烃上,所以这种构造上的特点使酚的性质与醇不完全相同。一般把醇类的羟基称为醇式羟基,酚类的羟基称为酚式羟基。 醚是醇或酚的衍生物。它可看作是醇或酚羟基上的氢被烃基(-R‘、Ar’)取代的化合物。 R-OH 醇 Ar-OH 酚R-O-R‘醚
(Ar)(Ar`) 醇、酚和醚是重要的有机化合物。有的在医药上可用作消毒剂、麻醉剂、溶剂,有的是有机合成的常用原料。 第一节 醇 一、醇的分类 醇可根据烃基的不同、羟基所连碳原子的类型、羟基数目等三种方法进行分类。 1.根据醇分子中烃基的不同,分为饱和醇、不饱和醇、脂环醇及芳香醇等。
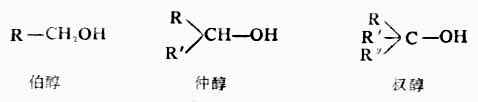
2.根据羟基所连接的碳原子种类不同,分为伯(1°)、仲(2°)和叔(3°)醇。
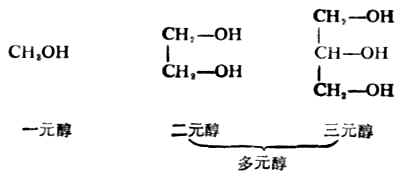
3.根据羟基数目的不同,分为一元醇、二元醇、三元醇等、含两个或两个以上羟基的醇又称为多元醇。例如:
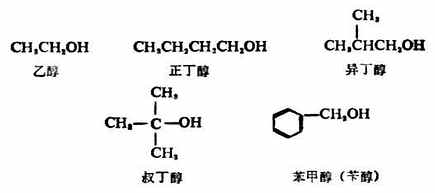
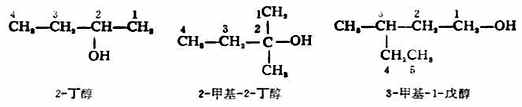
二、醇的命名 (一)普通命名法 简单的一元醇多用普通命名法命名。通常是在醇字前面加上烃基的名称,“基”字一般可以省略。例如:
(二)系统命名法 选择连有羟基碳原子在内的最长碳链为主链,从靠近羟基的一端开始编号,根据主链碳原子数称某醇。羟基位次用阿拉伯数字表明。支链或其它取代基按“次序规则”列出。
三、醇的性质 (一)物理性质 低级饱和一元醇是易挥发的液体,较高级的醇为粘稠的液体,C11及C11以上的醇为蜡状固体。由于羟基的存在,醇分子间可以形成氢键,故醇随着羟基的增多,形成氢键数目增多,所以多元醇具有更高的沸点。 低级的醇如甲醇、乙醇、丙醇等均能以任何比例与水混溶,这是因为醇羟基也可与水形成氢键,结果使醇有可能在水分子间取得位置而溶入水中。当醇中的烃基链增长时,由醇的烃基部分引起的分子之间的吸引力(即范德华力)就会超过醇羟基和水间的氢键引起的吸引力。结果醇在水中的溶解度就很快随着降低。例如:在25℃的100g水中,正丁醇的溶解度为7.9g、正己醇为0.6g、正辛醇为0.5g,而癸醇则不溶于水,不溶于非极性溶剂。表14-1是饱和一元醇的物理常数。 表14-1 一些饱和一元醇的物理常数 名称 构造式 熔点/℃ 沸点/℃ 相对密度20℃ 溶解度 g·(100水)-1,,25℃
甲醇
CH3OH
-97.8
64.5
0.792
∞
乙醇
CH3CH2OH
-117.3
78.5
0.789
∞
正丙醇
CH3CH2CH2OH
-127
97.8
0.804
∞
异丙醇
(CH3)2CHOH
-86
82.5
0.789
∞
正丁醇
CH3(CH2)2CH2OH
-89.8
117.7
0.810
7.9
异丁醇
(CH3)2CHCH2OH
-108
108
0.802
10.0
正戊醇
CH3(CH2)3CH2OH
-78.5
137.9
0.817
2.3
正己醇
CH3(CH2)4CH2OH
-52
156.5
0.819
0.6
正辛醇
CH3(CH2)6CH2OH
-15
195
0.827
0.05
正癸醇
CH3(CH2)8CH2OH
6
228
0.829
正十二醇
CH3(CH2)10CH2OH
24
259
0.831
苯甲醇
C6H5CH2OH
-15
205
1.046
2-苯基乙醇
C6H5CH2CH2OH
-26
219
1.013
4
环己醇
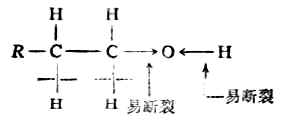
25 161 0.962 5.7 (二)化学性质 醇的官能团是羟基,它由氢氧两原子组成。氧原子的电负性较大,吸电子的能力较强,所以醇分子中的C-O键和O-H键都有明显的极性。键的极性有利于异裂反应的发生,所以C-O键和O-H键都比较活泼,多数反应都发生在这两个部位。另外,由于诱导效应,与羟基邻近的碳原子上的氢也参与某些反应。
醇与水相似,羟基里的氢可被活泼金属取代生成醇化物和氢氢气。例如: 2ROH+2Na→2RONa+H2↑ 醇钠 2CH3-CH2OH+2Na→2CH2CH2ONa+H2↑ 乙醇钠 醇与金属钠的反应不如水与金属反应时那样剧烈。这是由于烃基的斥电子作用,使羟基中氧原子上的电子云密度增加,减低了氧原子吸引氢氧间电子对的能力,降低了氢氧键的极性。 H-O:h R→O:h 由于上述诱导效应的存在,使得醇羟基中的氢不如水中的氢那样活泼,不易成为离子,所以反应也较缓和。由此可见,烃基的斥电子能力愈强,醇羟基中氢原子的活泼性愈低,与金属钠的反应就愈缓慢。故伯、仲、叔醇中,伯醇与钠反应速率最快,叔醇 最慢。 醇钠是白色固体,遇水即水解,生成醇和氢氧化钠,因此醇钠的水溶液具有强碱性。 RONa+H2O→ROH+NaOh 除金属钠外,醇也可与锂、钾等其它活泼金属起类似的反应,生成相应醇的金属化合物,统称醇化物。 2.氧化反应 醇分子中的α碳原子上若有氢原子时,该氢原子受羟基的影响,比较活泼易于被氧化。用高锰酸钾或重铬酸钾加硫酸等氢氧化剂氧化为相应的醛或酮。例如,伯醇氧化生成醛,醛继续氧化生成羧酸;仲醇氧化生成酮。叔醇在同样条件下不易被氧化。
用催化脱氢的方法也可将醇氧化。在Cu 、Ag等金属催化下,醇经高温可失去两个氢原子而生成相应的醛和酮,此法可用于工业生产。
醇与氢卤酸作用时,醇中的羟基可被卤素取代,生成卤代烃和水。
4.脱水反应 醇与浓硫酸共热发生脱水反应,产物随反应条件及醇的类型而异在较高温度下,主要发生分子内的脱水(消除反应)生成烯烃;而在稍低温度下,则发生分子间脱水生成醚。
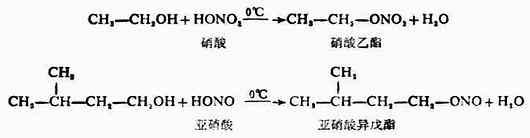
5.与无机酸反应 醇可与无机含氧酸如硝酸、亚硝酸β硫酸和磷酸等作用,失去一分子水而生成无机酸酯。例如:
含有无机酸酯的物质也广泛存在于人体内。如存在于软骨中的硫酸软骨质就是具有硫酸酯结构;组成细胞的重要万分核酸及磷脂中都含有磷酸酯的结构;体内某些代谢过程也往往通过形成磷酸酯作为中间产物。 (责任编辑:泉水) |

 不饱和醇的命名,应选择连有羟基同时含有双键或三键碳原子在内的碳链作业主链,编号时应以羟基位次为最小。例如:
不饱和醇的命名,应选择连有羟基同时含有双键或三键碳原子在内的碳链作业主链,编号时应以羟基位次为最小。例如: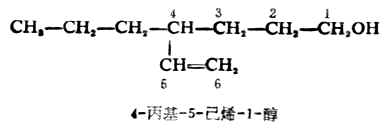 芳香醇也是按照上面的命名原则,把芳香烃当作取代基。例如:
芳香醇也是按照上面的命名原则,把芳香烃当作取代基。例如: 多元醇的命名是选择包括连有尽可能我的羟基的碳链作主链,依次基数称某二醇、某三醇等。因为羟基是连在不同碳原子上的,所以当羟基数与主链碳原子数相同时可以不必标明羟基位次。例如:
多元醇的命名是选择包括连有尽可能我的羟基的碳链作主链,依次基数称某二醇、某三醇等。因为羟基是连在不同碳原子上的,所以当羟基数与主链碳原子数相同时可以不必标明羟基位次。例如: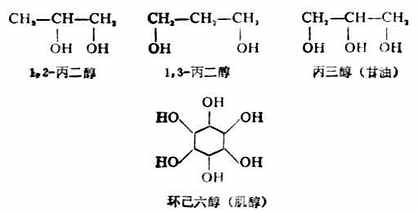
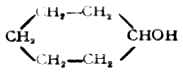
 1.与碱金属的反应
1.与碱金属的反应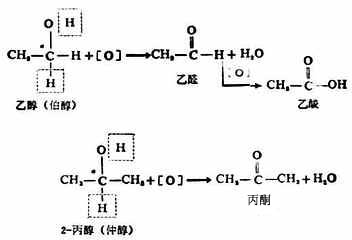 醇的氧化实质上是脱去两个氢原子,一个是羟基上的氢、一个是α碳(即与-OH相连的C)上的氢。因叔醇α碳上不连氢,所以在一般条件下不起氧化反应。但在反应条件剧烈时,则可发生分子断裂,产生含碳较少的产物。
醇的氧化实质上是脱去两个氢原子,一个是羟基上的氢、一个是α碳(即与-OH相连的C)上的氢。因叔醇α碳上不连氢,所以在一般条件下不起氧化反应。但在反应条件剧烈时,则可发生分子断裂,产生含碳较少的产物。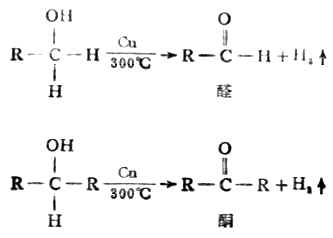 3.与氢卤酸的反应
3.与氢卤酸的反应 上述反应是可逆的,如其中一种反应物过量或移去产物水,可使平衡右移,提高卤代烃的收率。这个反应的速率与氢卤酸和醇的类型有关。当同一种醇与不同的氢卤酸作用时,反应速率是:HI>HBr>HCL。同一种氢卤酸与不同的醇作用时,反应速率是:叔醇>仲醇>伯醇。如用无水氯化锌作催化剂,浓盐酸可与叔醇立即反应,生成的卤代烃因不溶于反应试剂而呈混浊;如与仲醇反应,需几分钟才呈混浊;如与伯醇反应,则几小时也不见混浊。因此利用上述不同的反应速率,可作为区别伯、仲、叔醇的一种化学方法。这种由浓盐酸和无水氯化锌所配成的试剂又称为卢卡斯试剂。
上述反应是可逆的,如其中一种反应物过量或移去产物水,可使平衡右移,提高卤代烃的收率。这个反应的速率与氢卤酸和醇的类型有关。当同一种醇与不同的氢卤酸作用时,反应速率是:HI>HBr>HCL。同一种氢卤酸与不同的醇作用时,反应速率是:叔醇>仲醇>伯醇。如用无水氯化锌作催化剂,浓盐酸可与叔醇立即反应,生成的卤代烃因不溶于反应试剂而呈混浊;如与仲醇反应,需几分钟才呈混浊;如与伯醇反应,则几小时也不见混浊。因此利用上述不同的反应速率,可作为区别伯、仲、叔醇的一种化学方法。这种由浓盐酸和无水氯化锌所配成的试剂又称为卢卡斯试剂。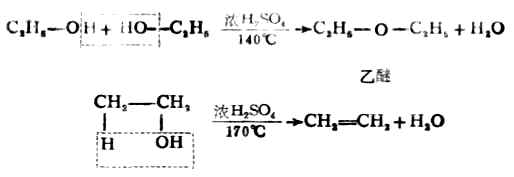 有些仲醇及叔醇的脱水可能生成两种烯烃。
有些仲醇及叔醇的脱水可能生成两种烯烃。
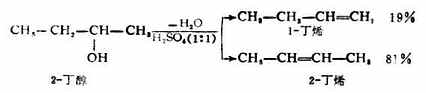 实验证明,醇脱水生成烯的反应主要产物是碳碳双键上连烃基最多的烯烃。即遵从扎依采夫规律。
实验证明,醇脱水生成烯的反应主要产物是碳碳双键上连烃基最多的烯烃。即遵从扎依采夫规律。
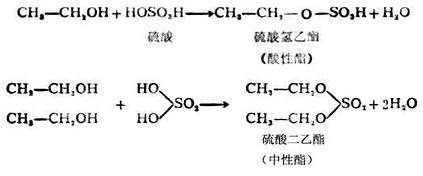
 硫酸是二元酸,除可与一分子乙醇作用生成酸性酯外,尚可与两分子乙醇生成中性酯。
硫酸是二元酸,除可与一分子乙醇作用生成酸性酯外,尚可与两分子乙醇生成中性酯。
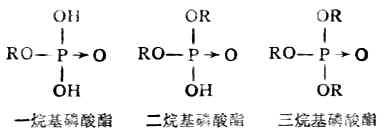
 磷酸是一个三元酸,它可以形成三种类型的磷酸酯。即:
磷酸是一个三元酸,它可以形成三种类型的磷酸酯。即:
 醇的无机酸具有多方面的作途。高级醇(含碳原子8-18个)的酸性硫酸酯的钠ROSO2Ona具有去垢作用,可用作洗涤剂;亚硝酸异戊酯是缓解心绞痛的药物;常用的杀虫药敌敌畏是具有磷酸酯结构的化合物。
醇的无机酸具有多方面的作途。高级醇(含碳原子8-18个)的酸性硫酸酯的钠ROSO2Ona具有去垢作用,可用作洗涤剂;亚硝酸异戊酯是缓解心绞痛的药物;常用的杀虫药敌敌畏是具有磷酸酯结构的化合物。