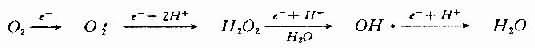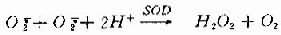|
这是其他活性氧产生的基础。过氧化氢(H2O2)及羟自由基(OH·)续发于此。即氧在获得一个电子时还原生成O2-,获得2个电子生成H2O2,获得3个电子生成OH·,获得四个电子生成H2O。
H2O2既可由O2-自发歧化产生,也可经酶促歧化而生成。
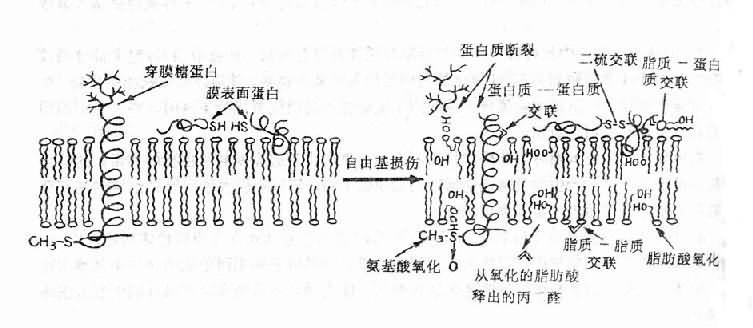
H2O2本身并非自由基而是一种活性氧,它与氧自由基的产生有密切关系(详下文)。 OH·自由基的产生不仅需要O2-或H2O2,而且要有过渡金属,如铁的螯合物的存在。由铁催化的Fenton型Haber-Weiss反应可迅速形成OH·,而单纯的Haber-W-eiss反应速度很慢,很难由此形成OH·。 O2-+H2O2→O2+OH-+OH· (Haber-Weiss反应) Fe(Ⅲ)+O2-→fe(Ⅱ)+O2 (2) Fe(Ⅱ)H2O2 →Fe(Ⅲ)+OH-+OH· (3) 也就是说,O2-使铁还原,还原的铁再使H2O2还原生成OH·,OH·是最活跃最强力的氧自由基。缺血与再灌注时氧自由基生成过多,其机制可能是: 1.黄嘌呤氧化酶的形成增多 黄嘌呤氧化酶(xanthine ocidase, XO)的前身是黄嘌呤脱氢酶(xanthine dehydrogenase, XD)。这两种酶主要存在于毛细血管内皮细胞内。正常时只有10%以XO的形式存在,90%为XD。缺血时由于ATP减少,膜泵功能失灵,Ca2+进入细胞激活Ca2+依赖性蛋白水解酶,使XD大量转变为XO。缺血时ATP不能用来释放能量,而且还依次降解为ADP、AMP和次黄嘌呤,故在缺血组织内次黄嘌呤大量堆积。再灌注时,大量分子氧随血液进入缺血组织,黄嘌呤氧化酶在催化次黄嘌呤转变为黄嘌呤并进而催化黄嘌吟转变为尿酸的两步反应中,都同时以分子氧为电子接受体,从而产生大量的O2-和H2O2,后者再在金属离子参与下形成OH·。因此,再灌注时组织内O2-、OH·等氧自由基大量增加。 2.中性粒细胞 中性粒细胞在吞噬活动时耗氧量显著增加,所摄取的O2绝大部分经细胞内的NADPH氧化酶和NADH氧化酶的作用而形成氧自由基,并用以杀灭病原微生物。如氧自由基产生过多或机体清除氧自由基的酶系统活性不足或抗氧化剂不够时,中性粒细胞形成的氧自由基就可损害组织。 在再灌注时,由黄嘌呤氧化酶的作用所产生的氧自由基起原发的、主要的作用;这些自由基作用于细胞膜后产生的具有趋化活性的物质如LTB4等可吸引大量中性粒细胞到局部释放氧自由基等物质而进一步损害组织。 3.线粒体 可能是由于缺氧使ATP减少,Ca2+进入线粒体增多而使线粒体功能受损,细胞色素氧化酶系统功能失调,以致进入细胞内的氧,经单电子还原而形成的氧自由基增多而经4价还原而形成的水减少。细胞色素氧化酶的功能失调,也可能是缺氧时细胞内氧分压降低的结果。 4.儿茶酚胺的增加 交感-肾上腺髓质系统是机体在应激时的重要调节系统。在各种应激包括缺氧的条件下,此系统分泌大量的儿茶酚胺,儿茶酚胺一方面具有重要的代偿调节作用,但过多的儿茶酚胺特别是它的氧化产物,往往又成为对机体的有害因素。实验证明,大量的异丙肾上腺素、去甲肾上腺素、肾上腺素均能引起细胞损伤。造成心肌损害的是儿茶酚胺的氧化产物,而非儿茶酚胺本身。儿茶酚胺氧化能产生具有细胞毒性的氧自由基。肾上腺素代谢产生紧上腺素红的过程中有O2-产生。 (二)自由基反应与再灌注损伤 机体在生命过程中所能遇到的自由基种类很多。因此很难概括其生物学反应。自由基参与一个反应系统后能形成新的自由基。因此自由基一旦形成,就成为自由基反应扩展程序的一部分,例如: R·+XH→RH+H· R·+CCl4→RCl+Cl3C· 另一个自由基反应则是自由基加入到不饱和键中去。如脂肪酸及芳香族环的不饱和键。 自由基反应既可经自由基中间代谢产物不断向前发展,又可由细胞损伤而终止。自由基反应的扩展可以是无限的,但又可为各种自由基清除剂(free radical scavenger)所终止。 由于自由基有极为活泼的反应性,所以它们能和各种细胞成分(膜磷脂、蛋白、核酸)发生反应。 (1)膜脂:是构成膜脂质双层的重要结构及功能成分,富含不饱和脂肪酸,自由基与不饱和脂肪酸作用引发脂质过氧化(lipid peroxidation)反应。脂质过氧化物的形成使膜受体、膜蛋白酶和离子通道的脂质微环境改变,从而改变它们功能,由于脂质过氧化反应的增强,细胞膜内多价不饱和脂肪酸减少,生物膜不饱和脂肪酸/蛋白质比例失常,膜的液态性、流动性改变,通透性增强。含双键脂肪酸过氧化可生成丙二醛,它的产生与脂质过氧化相平行,因而测定丙二醛含量可代表脂质过氧化物的浓度。丙二醛能使膜成分之间形成交联和聚合(polymerization),使膜的基本特性如变构、离子传递、酶活性等发生改变(图11-3)。
图11-3 自由基对膜的损伤 自由基可通过诱致过氧化而影响脂质,从而产生短链脂酰衍化物和副产物 (2)蛋白质:在自由基的作用下,胞浆及膜蛋白及某些酶可交联成二聚体或更大的聚合物。这种交联既可借助于蛋白质之间的二硫键形成也可由于自由基损伤的氨基酸残基间的反应形成。蛋白质的交联将使其失去活性,结构改变。 (3)核酸:自由基对细胞的毒性作用主要表现为染色体畸变,核酸碱基改变或DNA断裂。80%是OH·的作用。OH·易与脱氧核糖及硷基反应并使其改变。 (三)细胞对自由基损伤的防护 自由基的产生既然是有机体在正常或病理条件下的常见现象,因此在进化过程中也就形成了一系列对抗自由基,防止其损伤的系统。这种生化学防护系统主要有两大类:低分子自由基清除剂及复合酶系统。 1.低分子清除剂 存在于细胞脂质部分的自由基清除剂有维生素E(α-生育酚)和维生素A(β-胡萝卜素);存在于细胞内外水相中的自由基清除剂有半胱氨酸、抗坏血酸和谷胱甘肽等,它们能提供电子使自由基还原,故有重要的防护作用。例如维生素E(生育酚)能还原O2-、单线态氧(1O2)、过氧化脂质自由基等;抗坏血酸具有相同作用而且能协助生育酚维持其具有活性的还原状态。β-胡萝卜素是单线态氧(1O2)的有效清除剂并能抑制脂质过氧化。 胞浆中的还原型谷胱甘肽(GSH)与还原型辅酶Ⅱ(NADPH)在某些酶如过氧化氢酶、谷胱甘肽过氧化物酶等的协同作用下,能还原H2O2、过氧化脂质、二硫化物及某些自由基。 2.酶性清除剂 细胞内有二种酶可以清除H2O2,即过氧化氢酶和过氧化物酶。如所周知H2O2是OH·自由基的前身,上述两酶可使H2O2浓度降低,从而避免高毒性OH·的产生。这两个酶的细胞内分布,尚不清楚。 细胞内具有清除剂作用的另一个重要酶是超氧化物歧化酶(SOD)。它是一种金属蛋白,可以歧化O2-生成H2O2。哺乳类细胞含有两种SOD。其一是位于胞浆中的CuZn 超氧化物歧化酶,另一是位于线粒体中的Mn超氧化物歧化酶。SOD作用的重要意义,在于清除H2O2及OH·的前身O2-,从而保护细胞不受强毒性氧自由基的损伤。 清除剂的浓度及活性下降必将引起自由基所致之细胞损伤。 (四)自由基在缺血再灌注损伤机制中的地位 缺血/再灌注损伤机制中的各种学说,无一不与自由基的作用有关。 1.缺血/再灌注时脂质过氧化增强(自由基引发),组织及血浆中脂质过氧化物显著增高,超微结构严重受损。给予抗氧化剂如:维生素E、硒(谷胱甘肽过氧化物酶辅基所含金属)及SOD能显著减轻缺血/再灌注损伤。 2.细胞膜脂质过氧化改变膜酶、离子通道的脂质微环境,从而使膜通透性增高,细胞外钙离子内流。膜上Na+-K+-ATP酶失活,可使细胞内Na+升高,Na+-Ca2+交换增强。而使细胞内钙超载。 3.线粒体膜富有磷脂,缺血/再灌注时自由基引发的线粒体膜脂质过氧化或细胞内形成脂质过氧化物作用于线粒体膜,使膜的液态及流动性改变,从而导致线粒体功能障碍,高能磷酸化物产生减少,自由基产生增多。细胞丧失能量贮备。依靠能量的质膜及肌浆网膜钙泵,由于能量不足不能将肌浆中过多的Ca2+泵出或吸收入肌浆网,致使肌细胞内Ca2+浓度增加,加上由细胞外来的Ca2+终于造成细胞内Ca2+超载,成为细胞致死原因。 4.自由基引发的脂质过氧化造成细胞成分间的交联(脂质-脂质交联、蛋白-蛋白交联、脂质-蛋白交联、蛋白-胶原交联),使整个细胞丧失功能。 5.缺血/再灌注时,微粒体及质膜上的脂加氧酶(lipoxygenase)及环加氧酶(cyclooxygenase)激活,催化花生四烯酸代谢,在加强自由基产生及脂质过氧化的同时形成具有高度生物活性的物质,如前列腺素、血栓素等。很多实验证明,缺血特别是再灌注时血栓素形成增加,前列环素形成减少,因而造成微循环障碍,出现无复流现象。 总之,自由基即使不是缺血/再灌注损伤的唯一发病学因素,至少也是甚为重要的环节。 (责任编辑:泉水) |
第三节 缺血/再灌注损伤的机制(2)
时间:2006-06-19 20:31来源:大众医药网 作者:admin
顶一下
(2)
100%
踩一下
(0)
0%
------分隔线----------------------------
- 上一篇:第四节 防治缺血/再灌注损伤的展望
- 下一篇:第二节 心、脑、肠的缺血/再灌注损伤
- 发表评论
-
- 最新评论 进入详细评论页>>