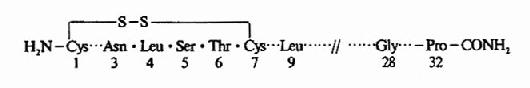|
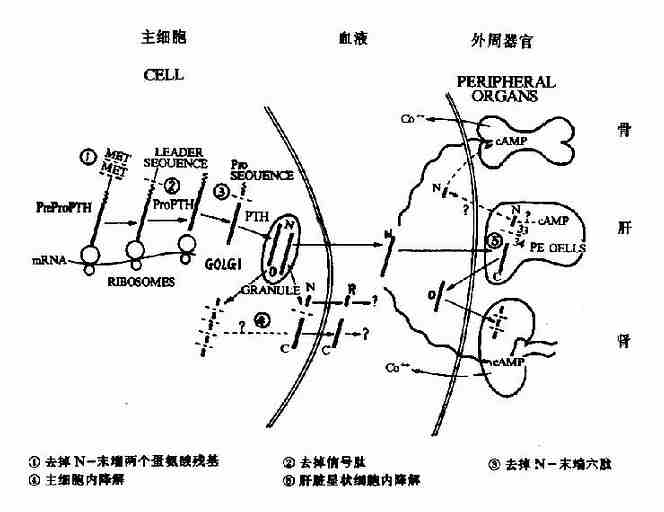
(4)实验表明,胶原纤维的成熟和骨样组织的正常,是骨盐沉着的重要前提。 骨的生成和钙化是一个复杂的生物过程,受多种因素的影响和调节,此方面的研究正在深入进行,并取得了一些可喜的进展。如发现了多种与骨生成相关的蛋白及细胞因子等。 (三)溶骨作用与脱钙 骨在不断的新旧更替之中,原有旧骨的溶解和消失称为骨的吸收(bone resorption)或溶骨作用(osteolysis)。溶骨作用包括基质的水解和骨盐的溶解,后者又称为脱钙(decalcification)。溶骨作用同成骨作用一样,是通过骨组织细胞的代谢活动完成的。溶骨作用主要由破骨细胞引起,可分为细胞外相和细胞内相两相完成。 破骨作用起始于细胞外。破骨细胞通过接触骨面的刷状缘,溶酶体释放出多种水解酶类,如胶原酶可水解胶原纤维,糖苷酶水解氨基多糖。同时,破骨细胞通过糖元分解代谢产生大量乳酸,丙酮酸等酸性物质扩散到溶骨区,使局部酸性增加,促使羟磷灰石从解聚的胶原中释出。破骨细胞产生柠檬酸能与Ca2+结合形成不解离的柠檬酸钙,降低局部Ca++的浓度,从而促进磷酸钙的溶解。继后,多肽、羟磷灰石等经胞饮作用进入破骨细胞,并与溶酶体溶合形成次级溶酶体。在此多肽水解为氨基酸、羟磷灰石转变为可溶性钙盐。最后,氨基酸、磷及Ca2+从破骨细胞释放入细胞外液,再入血,可参与血磷、血钙的组成。因骨的有机质主要为胶原,溶骨作用增强时,血及尿中羟脯氨酸增高。因此可将血及尿中羟脯氨酸的量作为溶骨程度的参考指标。 正常成人,成骨与溶骨作用维持动态平衡,每年骨的更新率约1?%。骨骼发育生长时期,成骨作用大于溶骨作用。而老年人则骨的吸收明显大于骨的生成,骨质减少而易发生骨质疏松症(osteoporosis)。骨盐在骨中沉积或释放,直接影响血钙、血磷水平,在平时骨中约有1%的骨盐与血中的钙经常进行交换维持平衡,因此血钙浓度与骨代谢密切相关。 四、钙磷代谢的调节 体内钙、磷代谢的平衡主要由甲状旁腺素、1,25-(OH)2D3和降钙素来调节。 (一)甲状旁腺素(Parathormone,PTH) 1.合成及分泌 甲状旁腺素是由甲状旁腺主细胞合成和分泌的一种单链多肽激素,成熟PTH含84个氨基酸残基,分子量约为9500。是维持血钙恒定的主要激素。 PTH的合成遵循典型的胞内多肽合成途径。首先合成的是含115个氨基酸的前甲状旁腺激素原(Pre Pro PTH)。在粗面内质网切除N?端25个氨基酸的信号肽,降解为激素原(Pro PTH),含90个氨基酸残基,无生理活性。Pro PTH在高尔基体中进一步切去N?端6个氨基酸残基,组装为成熟的、具生物活性的PTH分泌颗粒。(图12-4)。
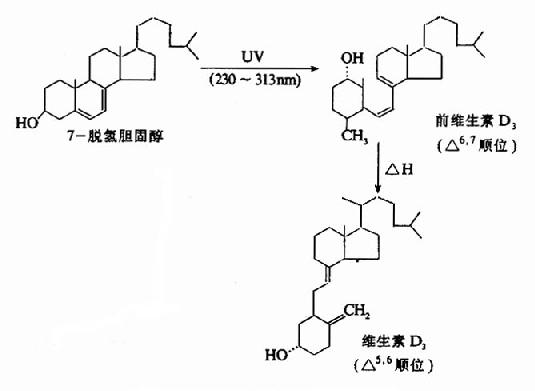
图12-4 PTH及其前体的合成、分泌及代谢 完全相同的生物活性。主要受体结合位点在1-6,它的切除会导致全部生物活性丧失。C-未端片断不具有生物活性,但决定PTH的免疫原性,这在PTH放射免疫测定时应注意。 PTH在血液中的半衰期仅数分钟,甲状旁腺细胞内PTH的储存亦有限。因而,分泌细胞不断进行PTH的合成及分泌。血钙是调节PTH水平的主要因素,血钙不仅调节PTH的分泌,而且影响PTH的降解。低血钙的即刻效应(几秒钟内)是刺激贮存的PTH的释放,而持续作用主要是抑制PTH的降解速度。后者是调节外周血PTH水平的主要机制。当血Ca2+水平下降时,体内PTH降解速度减慢,血中PTH水平增高。此外,1,25-(OH)2D3与PTH分泌也有关系,当血中1,25-(OH)2D3增多时,PTH的分泌减少,降钙素则可促进PTH分泌。一方面是通过降低血钙的间接作用,另一方面可直接刺激甲状旁腺分泌PTH。 (二)生理作用?PTH作用的靶器官是肾脏,骨骼和小肠。PTH作用于靶细胞膜 上腺苷酸环化酶系统,增加胞浆内cAMP及焦磷酸盐(PPi)的水平。前者促进线粒体内Ca2+向胞浆透出,后者则作用于细胞膜外侧,增加Ca2+向细胞内透入,使细胞浆Ca2+浓度升高,于是细胞膜上的“钙泵”被激活,将Ca2+大量输送到细胞外液。PTH作用的总效应是升高血钙。 1.对骨的作用 PTH具有促进成骨和溶骨的双重作用。实验研究表明小剂量PTH可促进成骨作用,而大剂量则可促进溶骨作用。PTH可刺激骨细胞分泌胰岛素样生长因子I(IGF桰),从而促进骨胶原和基质的合成,利于成骨作用。临床上利用此作用,给骨质疏松症患者连续使用小剂量PTH治疗,取得良好疗效。另一方面PTH能使骨组织中破骨细胞的数量和活性增加,破骨细胞分泌各种水解酶,并且产生大量乳酸和柠檬酸等酸性物质,使骨基质及骨盐溶解,释放钙和磷到细胞外液。但PTH只引起血钙升高;而血磷却减少,其原因在于PTH对肾脏的作用。 2.对肾脏的作用 PTH对肾脏作用出现最早,主要是增加肾近曲小管对Ca2+的重吸收,降低肾磷排泄阈并抑制肾小管对磷的重吸收。其机理是通过细胞膜受体和cAMP系统,改变细胞膜对Ca2+通透性,使Ca2+内流增多、胞浆内Ca2+浓度升高,减低腔面对Na+通透性,Na+桯+交换减少,Na+、HCO3-排出增多,磷排出也相应增加。同时,通过浆膜面的“钙泵”使Ca2+进入血液,其结果使尿钙减少,尿磷增多,最终使血钙升高,血磷降低。 3.对小肠的作用 PTH对小肠的钙、磷吸收的影响,一般认为是通过激活肾脏1α-羟化酶,促进1,25-(OH)2D3的合成而间接发挥作用的,此效应出现得较为缓慢。 (二)1,25-(OH)2D3 1.合成及调节 1,25-(OH)2D3是一种激素,由维生素D3在体内代谢生成,是维生素D3在体内的主要生理活性形式。维生素D3及其前体在皮肤、肝、肾等经过一系列的酶促反应生成1,25-(OH)2D3,再经血液运输到小肠、骨及肾等靶器官发挥生理作用。 皮肤:胆固醇代谢中间产物在皮肤分布较多。在紫外线照射下先转变为前维生素D3(previtamin D3),后者在体温条件下经36小时自动异构化为维生素D3(图12-5)。
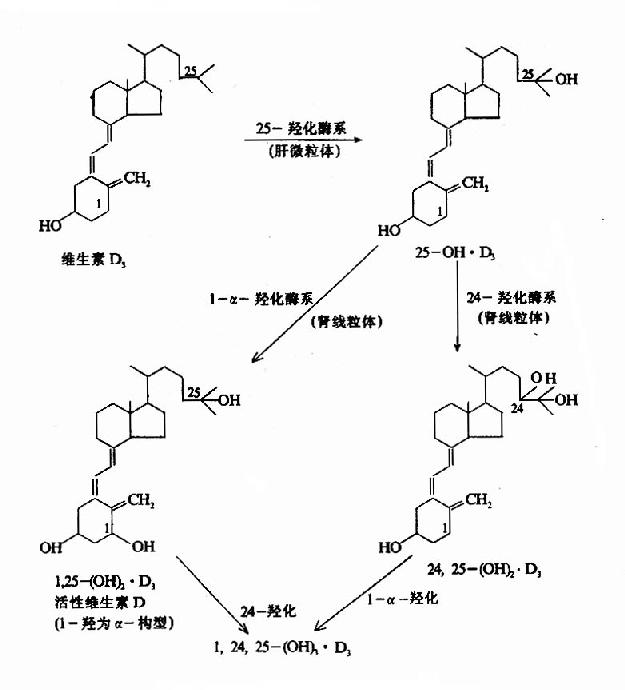
图12-5 维生素D3的生成 (2)肝脏:皮下转化生成及肠道吸收的维生素D3入血后,与维生素D结合蛋白(DBP)结合运送到肝脏,在肝细胞微粒体中维生素D-25羟化酶催化,转变为25-(OH)D3。维生素D-25羟化酶受产物25-(OH)D3的反馈抑制。合成的25-(OH)D3再与DBP结合而运输,它是血浆中维生素D3的主要形式。 (3)肾脏:肝脏生成的25-OH)D3经血运往肾脏,在肾近曲小管上皮细胞线粒体内1α-羟化酶系(包括黄素酶、铁硫蛋白和细胞色素P450)的作用下,转变成1,25-(OH)2D3。此外,肾脏中还有24,25-(OH)2D3及1,24,25-(OH)2D3等代谢产物。其活性均较弱。(图12-6)。
图12-6 维生素D3的代谢 (4)调节:1,25-(OH)2D3的合成受多种因素影响和调控。主要通过1α-羟化酶调节,主要影响因素有PTH、血液和细胞外液磷酸盐浓度、1,25-(OH)2D3及血钙等。 PTH是1α-羟化酶的主要调节者。PTH能促进1α-羟化酶合成,抑制24α-羟化酶,从而使25-(OH)D3转变为1,25-(OH)2D3增多,转变为24,25-(OH)2D3减少。低血钙由于使PTH升高而刺激1,25-(OH)2D3的生成。低血磷可刺激1α-羟化酶活性,且低血磷刺激1,25-(OH)2D3合成作用不依赖于PTH。此外,维生素D3不仅不受1α-羟化酶作用,而且还抑制1α-羟化酶。 2.1,25—OH)2D3的生理作用 1,25-(OH)2D3作用的靶器官是小肠、骨,而对肾脏作用较弱。 (1)对小肠的作用:1,25-(OH)2D3能促进小肠对钙、磷的吸收,这是其最主要的生理功。1,25-(OH)2D3与小肠粘膜细胞内的特异胞浆受体结合,进入细胞核内,促进DNA转录生成mRNA,从而使钙结合蛋白(calcium binding protein,CaBp)和 Ca2+-Mg2+?ATP酶)合成增高。从而使进Ca2+的吸收转运。同时1,25-(OH)2D3可影响小肠粘膜细胞膜磷脂的合成及不饱合脂肪酸的量,增加Ca2+的通透性,利于肠腔内Ca2+的吸收。1,25—OH)2D3促进Ca2+吸收同时伴随磷吸收的增强,但对磷吸收的作用机制尚未了解清楚。 (2)对骨的作用,1,25-(OH)2D3对骨亦有溶骨和成骨的双重作用。体外实验证明,1,25-(OH)2D3能刺激破骨细胞活性和加速破骨细胞的生成,从而促进溶骨作用。在体内则与PTH协同作用,促进破骨细胞增生,并增强其破骨作用。另一方面,由于1,25-(OH)2D3增加小肠对钙、磷的吸收,提高血钙、血磷,又促进钙化。同时,1,25-(OH)2D3还刺激成骨细胞分泌胶原等,促进骨的生成。所以,在钙、磷供应充足时,1,25-(OH)2D3主要促进成骨。当血钙降低、肠道钙吸收不足时,主要促进溶骨,使血钙升高。 (3)对肾的作用1,25—(OH)2D3可促进肾小管对钙、磷的重吸收。但此作用较弱,处于次要地位。只在骨骼生长和修复期,钙、磷供应不足情况下较明显。 1,25-(OH)2D3总的调节效果是使血钙、血磷增高。 (三)降钙素(Calcitonin CT) 1.化学本质 降钙素是由甲状腺滤泡旁细胞(又称C细胞)所分泌的一种单链多肽类激素,由32个氨基酸组成,分子量为3500。N-末端1,7位氨基酸为半胱氨酸,以二硫键相连,形成一个封闭环,C-末端为脯氨酸。分子内部的氨基酸顺序变化较大,不同种类CT,32个氨基酸中只有9个位置是相同的(图12?7)。但从体结构来看,这几种CT的结构又很相似,其所有亲水和疏?
图12-7 猪、牛、鲑鱼和人类降钙素的共性结构 水氨基酸残基的位置相对固定。如疏水基的酪氨酸、苯丙氨酸、亮氨酸在分子中有规律的间隔出现(4、9、12、16、19、22位),带电荷的酸性氨基酸都在15和30位上。如天冬氨酸、谷氨酸、甘氨酸。所以每种CT对各种哺乳动物都有生物活性。一般认为CT生物活性有赖于分子中32个氨基酸结构的完整性,目前对此说法有一些新的见解,并取得一些新进展。例如人工合成一种自19?22氨基酸残基单个缺失或片断缺失的鲑鱼CT同类物,其降钙作用为天然鲑鱼CT的2倍。 2.CT的合成与分泌 在人甲状腺C细胞中以CT mRNA为模板的最初翻译产物是分子量约15000的蛋白,经过修饰先转变为分子量12000的产物,最后转变为3500的成熟CT。血钙是影响CT分泌的主要因素。血钙升高可刺激CT的分泌。血钙降低则抑制CT的分泌,但CT合成的速度不受影响,因而细胞内CT含量增高。甲状旁腺功能低下患者,其C细胞中CT含量亦增多。 (责任编辑:泉水) |
第十二章 钙磷代谢及微量元素- -第一节 钙磷代谢(2)
时间:2006-06-20 10:47来源:大众医药网 作者:admin
顶一下
(8)
100%
踩一下
(0)
0%
------分隔线----------------------------
- 发表评论
-
- 最新评论 进入详细评论页>>