|
例3 测定Cu2+│Cu电极的标准电极电位, 解:将标准Cu2+│Cu电极与标准氢电极组成原电池。 Pt│H2(101.325kPa),H+(1mol.L-1)‖Cu2+(1mol.L-1)│Cu 298K时,测得Eφ=+0.3402(V)。 因为Cu2+│Cu电极的电位为正值,高于标准氢电极的电位。所以Cu2+│Cu电极,标准氢电极为负极。其电极反应和电池反应为, 电极反应 负极H2→2H++2e- 正极Cu2++2e-→Cu 电池反应 H2+Cu2+→2H++Cu (三)标准电极电位表 用上述方法不仅可以测定金属的标准电极电位,也可测定非金属离子和气体的标准电极电位。对于某些与水剧烈反应而不能直接测定的电极,可以通过热力学数据用间接的方法计算出标准电极电位。表6-1列出了298k 时,一些物质在水溶液中的标准电极电位。 为了正确使用标准电极电位表,将有关问题概述如下: 1.在电极反应式氧化型 化型和还原型包括电极反应所需的H+,OH-,H2O等物质,如
中是氧化型,在 中是还原型。所以在讨论与Fe2+有关的氧化还原反应时,若Fe2+是作为还原剂而被氧化为Fe3+,则必须用与还原型的Fe2+相对应的电对的 2.表6-1采用的电位是还原电位。不论电极进行氧化或还原反应,电极电位符号不改变。例如,不管电极反应是Zn→Zn2++2e-还是Zn2++2e-→Zn,Zn2+ │Zn电极标准电极电位值均取-0.7628V。 电极反应式左方的氧化型可作氧化剂,右方的还原型可作还原剂。氧化型在表的愈下方就是愈强的氧化剂;还原型在表的愈上方就是愈强的还原剂。因此,在不同的氧化剂或在不同的还原剂之间进行强弱比较时,根据标准电极电位的数值可以明确地判断它们的强弱。例如,在表上所列的各物质中,F2是最强的氧化剂,k 是最强的还原剂。 4.标准电极电位 5.电极电位和标准电极电位,都是电极处于平衡状态时表现时出来的特征,它和达到平衡的快慢无关。 根据上面所述,在标准状态下,由任何两个电极(半电极)组成电池时,电极电位较高的一方,由于有较强的氧化剂,起还原作用为正极;电极电位较低的一方,由于有较强的还原剂,起氧化作用为负极。 四、影响电极电位的因素 (一)能斯特(Nernst)方程式 一个电极的电极电位的大小与温度、浓度间的关系可用能斯特方程式表示:
式中 R——气体常数,8.314J-1.Kmol-1 F——法拉弟常数,96490C.mol-1 T——绝对温度,K n——电极反应得失的电子数 当温度为298K时,将各常数值代入式(6-2),并将自然对数转换成常用对数,能斯特方程式可改写为:
应用能斯特方程式时,应注意以下几点: 1.若电极反应式中有纯固体、纯液体或介质水时,它们的浓度不列入方程式中;气体物质用分压,即101.325kPa的倍数表示。 2.若电极反应式中氧化型、还原型物质前的系数不等于1时,则在方程式中它们的浓度项应以对应的系数为指数。 3. 氧化型、还原型物质包括与它们同存在的有关物质。例如, ,[氧化型]=[MnO4-][H+]8。 (二)有关能斯特方程式的计算 1.计算电极电位 利用能斯特方程式,可以计算不同条件下的电极电位值。 例4 计算298K,锌离子浓度为0.01mol.L-1时,Zn2+│Zn电极的电极电位。 解:电极反应
=-0.822(V) 在此例中,由于[Zn2+]<1mol.L-1,所以 例5 计算298K时,Pt│Fe3+(mol.L-1),Fe2+(0.001mol.L-1)电极的电极电位。 解: 电极反应:
从本例中可以看出,氧化型离子浓度愈大,或还原型离子愈小,电极电位愈高,表明氧化型得电子的倾向愈大。也就是说电极电位随着氧化型物质浓度增大而升高,随着还原型物质浓度增大而降低。 例6 求电极反应
在pH=5溶液中的电极电位(其他条件同标准状态)。 解:已知n=5,[MnO4+-]=[Mn2+]=1mol.L-1,[H+]=10-5mol.L-1,
计算结果表明,[H+]降低,对应的氧化型物质(MnO4-)的氧化能力降低。 2.判断原电池的正、负极,计算电动势 通常组成原电池的各有关物质并不是处于标准状态。计算原电池的电动势,首先根据标准电极电位表,利用能斯特方程计算出标准状态下各电极的电极电位。然后根据电极电位的高低判断正、负极,把电极电位高的电极作正极,电极电位低的电极作负极。正极的电极电位减去负极的电极电位即得原电池的电动势。 例7 计算298K时,电池Cu│Cu2+(0.1mol.L-1)‖Fe2+(0.1mol.L-1);Pt的电动势,并说明它是否按惯例书写正负极,列出电池反应式。 解:从表6-1中查出电极反应式及标准电极电位:
根据能斯特方程式,分别计算它们在非标准状态下的电极电位。
计算结果表明,电池右侧是正极,左侧是负极。该原电池是按惯例书写的。原电池的电动势为: E= 电极反应 负极 Cu→Cu2++2e-(氧化反应) 正极 Fe3++e- →Fe2+(还原反应) 电池反应 Cu+2Fe3+→Cu2++2Fe2+ 例8 计算298K时,电池Pt│I2,I-(0.1mol.L-1)‖MnO4-(0.1mol.L-1),Mn2+(0.1mol.L-1),H+(0.01mol.L-1)│Pt的电动势并写出电池反应式。 (责任编辑:泉水) |
第二节 电极电位(2)
时间:2006-07-01 21:43来源:大众医药网 作者:admin
顶一下
(8)
100%
踩一下
(0)
0%
------分隔线----------------------------
- 上一篇:第三节 电极电位的应用
- 下一篇:第六章 氧化还原与电极电位- -第一节 氧化还原
- 发表评论
-
- 最新评论 进入详细评论页>>
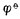 Cu2+/Cu。
Cu2+/Cu。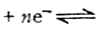 还原型中,ne表示电极反应的电子数。氧
还原型中,ne表示电极反应的电子数。氧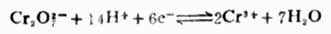 氧化型与还原型是相互依存的。同一种物质在某一电对中是氧化型,在另一电对中也可以是还原型。例如,
氧化型与还原型是相互依存的。同一种物质在某一电对中是氧化型,在另一电对中也可以是还原型。例如,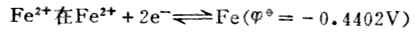
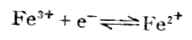 (
( 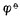 值(0.77V)。反之,若Fe2+是作为氧化剂而被还原为Fe,则必须用与氧化型的Fe2+相对应的电对的
值(0.77V)。反之,若Fe2+是作为氧化剂而被还原为Fe,则必须用与氧化型的Fe2+相对应的电对的 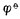 值(-0.88V)。
值(-0.88V)。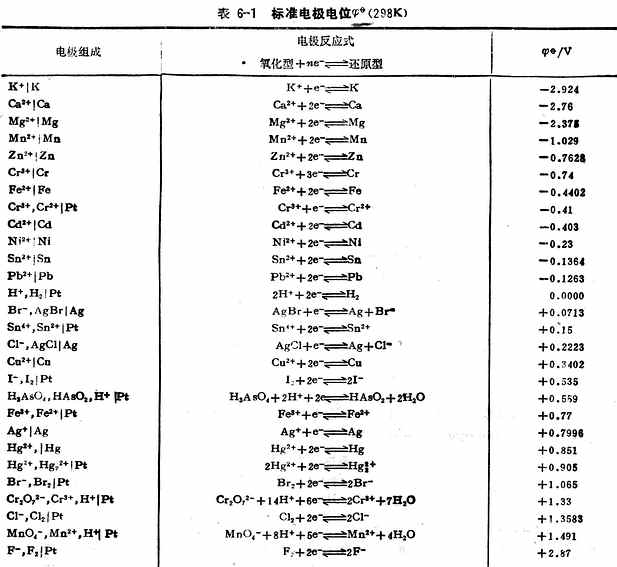
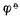 愈高,表示该电对的氧化型愈容易接受电子,氧化其它物质的能力愈强,它本身易被还原,是一个强氧化剂,而它的还原能力愈弱;
愈高,表示该电对的氧化型愈容易接受电子,氧化其它物质的能力愈强,它本身易被还原,是一个强氧化剂,而它的还原能力愈弱;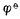 愈低,表示该电对的还原型愈容易放出电子,还原其它物质的能力愈强,它本身易被氧化,是一个强还原剂,而它的氧化型的氧化能力愈弱。
愈低,表示该电对的还原型愈容易放出电子,还原其它物质的能力愈强,它本身易被氧化,是一个强还原剂,而它的氧化型的氧化能力愈弱。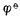 值与电极反应中物质的计量系数无关。例如,Ag+│Ag电极的电极反应写成,若写成。??
值与电极反应中物质的计量系数无关。例如,Ag+│Ag电极的电极反应写成,若写成。??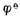 (Ag+/Ag)仍是+0.7996V,而不是2*0.7996V.
(Ag+/Ag)仍是+0.7996V,而不是2*0.7996V.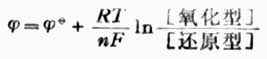 (6-2)
(6-2)
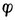 ——电极电位,单位为V
——电极电位,单位为V
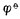 ——标准电极电位,单位为V
——标准电极电位,单位为V
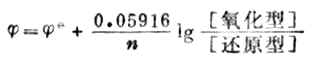 (6-3)
(6-3)
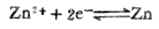 已知n=2,[Zn2+]=0.01mol.L-1,
已知n=2,[Zn2+]=0.01mol.L-1, 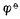 (Zn2+/Zn)=-0.7628V,则,
(Zn2+/Zn)=-0.7628V,则,
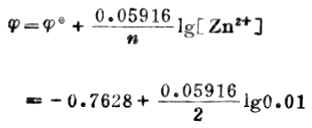 =-0.7628-0.05916
=-0.7628-0.05916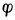
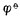 。若金属离子浓度愈小,则金属的电极电位愈低表明还原剂失电子的倾向增强了。
。若金属离子浓度愈小,则金属的电极电位愈低表明还原剂失电子的倾向增强了。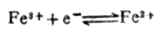 已知n=1,[Fe3+]=1mol.L-1,[Fe2+]=0.0001mol.L-1,
已知n=1,[Fe3+]=1mol.L-1,[Fe2+]=0.0001mol.L-1,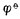 (Fe3+/Fe2+)=0.77V,则
(Fe3+/Fe2+)=0.77V,则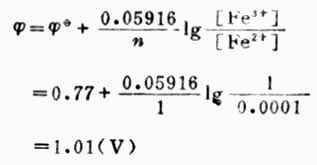
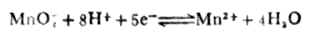
 (MnO4-/Mn2+)=+1.491V,则
(MnO4-/Mn2+)=+1.491V,则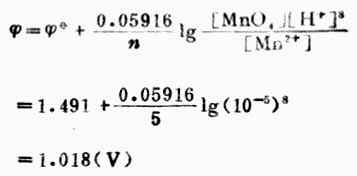
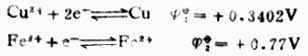

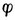 右-
右-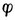 左=0.83-0.31=0.52(V)
左=0.83-0.31=0.52(V)
