|
3.化学性质 据目前所知,LP大致是一种较小分子的蛋白质,共耐热性低,加热70℃20分钟即可破坏其致热活性。蛋白酶如胃蛋白酶、胰蛋白酶或链霉蛋白酶,都能破坏其致热性。 LP在体内的动力学尚欠系统研究,但已知它主要由肾脏清除。 LP的分子量各家报道不一,多数认为人或兔的LP约13~15KD;也有人报道,人体提纯的LP有15KD和38KD两种,后者同样不耐热,也可为胰蛋白酶所破坏。后来的资料表明,较大分子的LP可能是分子量为15KD的LP的三聚体。据报道,人体和小鼠肿瘤细胞也可释出不同分子量的LP,可能是二聚体或三聚体。 LP的等电点有两型,即p17和p15这两型都有相同的致热性和其它生物活性。 4.抗原性和致热性交叉反应LP表现高度的抗原特异性。在兔体内对人体LP产生的抗体,只能破坏人体LP的致热性,而对家兔、豚鼠和猴的LP的致热性不能破坏。根据这种抗原特异性,有的实验室已建立对人体LP的放射免疫检测方法。 虽然LP有高度抗原特异性,但其致热性则在某些种系动物中可呈交叉反应。例如人体LP可引起家兔或小鼠发热;家兔LP能引起蜥蜴发热,大鼠LP可引起家兔发热。这种交叉致热性表明,上述不同种系动物产生的LP,必然有共同的有效部分,能为其靶细胞的特异受体所接受。 5.生物学效应 LP有明显的致热性。从家兔渗出白细胞制备的LP,其粗提物的致热性约为300~400μg蛋白质引起家兔(约2.5~3.0kg体重)平均发热1℃;经滤膜过滤和层析滤过而获得的较纯的LP,致热性约为0.1~0.2μg引起家兔发热1℃。表明LP的致热性很强。 除发热效应之外,LP还能引起疾病急性期的多种反应,包括中性粒细胞增多、低铁血症、低锌血症、高铜血症、肝脏急性期蛋白合成增多。后者包括纤维蛋白原、结合珠蛋白、血浆铜蓝蛋白、C-反应蛋白、α1-抗胰蛋白酶、血清淀粉样物质A及某些补体成分等。与此同时还出现肌肉蛋白水解增多和氨基酸血症,以保证急性期蛋白合成增多的需要。因此,LP是疾病急性期反应的一种中介分子或系列中介分子之一。 (二)新发现的内生致热原 除LP外,近年来又发现三种内生致热原。 1.干扰素 干扰素(interferon,IFN)是细胞对病毒感染的反应产物,这种糖蛋白物质去糖后仍具活性。由人类白细胞诱生的hIFN,已应用于临床,有抗病毒,抑制细胞尤其肿瘤细胞生长的作用。1984年Dinarello等证明,给家兔静脉内注射hIFN。能引起单相热,其致热性不是由于污染ET。对ET产生耐受性的小鼠,注射hIFN仍引起发热且不减弱;其致热性也不是由于LP的作用。在家兔hIFN性发热期间,循环血未出现LP;体外培育单核细胞加入适量hIFN不引起LP的释放。给猫脑室内(intracerebroventricular,ICV)注射hIFN照例引起发热,表明它本身具有致热性。 2.肿瘤坏死因子 肿瘤坏死因子(tumor necrosis factor,TNF)也是巨噬细胞分泌的一种蛋白质,ET能诱生之。重组TNF(rTNF)已用于临床1期治疗肿瘤,有非特异杀伤肿瘤细胞的作用,给人注射能引起发热反应。Dinarello等(1986)用家兔实验验证其致热性:静脉内注射1μg/kg迅速引起单相热,10μg/kg引起双相热,在第二热相血浆中出现循环LP。体外实验证明。rTNF能激活单核细胞产生LP。TNF在70℃中加热30分钟,失去致热性50%。加热的10μg/kg只引起单相热。但LP加热70℃30分钟,则失去全部致热性。TNF不同于ET,每天注射不出现耐受性。Dinarello等认为TNF双相热的第一热峰是TNF直接作用于体温调节中枢所致,第二热相是通过LP而引起的。 3.巨噬细胞炎症蛋白-1 最近Wolpe等(1988)新发现一种单核细胞因子,是一种肝素-结合蛋白质,对人体多形核白细胞有化学促活作用(chemokinesis),在体外能引起中性粒细胞产生H2O2,皮下注射此因子能引起炎症反应,故称之为巨噬细胞炎症蛋白-1(macrophageinflammatory protein-1,MIP-1)。进一步研究(Davatelis等,1989)发现,MIP-1给家兔静脉内注射引起剂量依赖性发热反应,热型呈单相。其致热性既不是由于污染ET,也不是由于含有LP或TNF,也不依赖于PGE,表明它是另一种具有致热性的EP。 四、致热原的作用部位 哺乳类动物和人类的体温相对恒定,是依赖体温调节中枢调控产热和散热的平衡来维持的。视前区-前下脑(preoptic anterior hypothalamus,POAH)是体温调节中枢的高级部分,次级部分是延脑、桥脑、中脑和脊髓等。当POAH进行正常活动时,次级中枢退居次要或备用地位。而当POAH失去活动(如被病灶或人工破坏)时,次级中枢可能取代之而发挥积极作用。无论对体温调节或致热原的反应,可能都是如此。 至于致热原(包括ET或LP)的作用部位,迄今尚难确定。许多实验证明,在脑内存在着对ET或LP起反应的敏感区。用直接微量注射的方法显示,这种敏感区正好集中于下丘脑体温调节中枢,其它中枢部位的敏感性较低或不敏感。因此,只要有小量ET或LP通过血脑屏障进入脑内,就有可能作用于敏感区而引起发热效应。目前还未有证据可以表明,ET或LP能作用于外周温度感受器或其它外周调温结构而引起发热。 由于ET的分子量很大,LP的分子量较小,因此多数学者认为,循环ET不能通过血脑屏障而作用于POAH,LP则能通过血脑屏障而作用于POAH。其实至今对此仍不能最后肯定或否定。关于ET能否通过血脑屏障,前文已有论述。关于LP,近年来有的学者提出其作用部位可能位于血脑屏障外的脑血管区。这个特殊部位,称为下丘脑终板血管器(organum vasculosum laminae terminalis,OVLT)位于第三脑室壁的视上隐窝处(图4-2)。这里的毛细血管属于有孔毛细血管,LP可能通过这种毛细血管而作用于血管外周间隙中的巨噬细胞,由后者释放介质再作用于OVLT区神通元(与POAH相联系)或弥散通过室管膜血脑屏障的紧密连接,而作用于POAH的神经元。这种主张也有待进一步验证。
图4-2 OVLT在发热病学中的作用示意图(引自Stitt,1986) 近年来新发现的三种内生致热原的作用部位尚待确定。 五、内生致热原的作用方式 无论EP是否通过血脑屏障,它在给动物静脉内注射后,总要经过一段潜伏期才引起发热。因而它很可能要通过某种或多个中间环节,导致调定点上移,再通过调温反应而引起发热。
许多学者推测有某种或某些中枢介质(也称中枢发热介质)参与发热的中枢机制。先后被研究的有单胺(去甲肾上腺素、5-羟色胺)、前列腺素E(PGE)、花生四烯酸的其它衍生物,cAMP和Na+/Ca2+比值等。而最受重视的是PGE、cAMP和Na+/Ca2+比值。 (一)前列腺素主张PGE是EP引起发热的主要介质的现行假说的最重要依据是:①脑内(下丘脑)或ICV注射PGE引起发热;②LP静脉内注射或IFn ICV注射引起发热是时,CSF中PGE2明显增多;③下脑组织分别与LP、IFN或TNF在体外培育时,都使PGE2合成增多;④阻断PGE合成的药物,对LP、IFN或TNF性发热都能解热。 鉴于目前仍无直接证据以示LP能从外周进入脑内,因而有的学者修改了此假说,提出PGE的释放部位是在OVLT区孔性毛细血管外周的巨噬细胞(参阅图4-2)。LP激活后者释出PGE,作用于OVLT区的神经元或弥散过室管膜细胞紧密连接而作用于POAH的神经元。 此外,Dinarello等(1986)认为TNF引起的双相热的第一相,是TNF引起下丘脑PGE增多的效应。 但是许多资料不支持PGE作为发热介质,其根据是:(1)PGE的两种特异拮抗物SC19220和HR546能抑止PGE性发热,但不能抑制LP性发热;(2)小剂量阿司匹林在抑制LP引起的CSF PGE增多的同时,可不抑制体温上升;(3)家兔两侧POAH摘除或损伤后,向该处或ICV注入PGE均不引起发热,但ICV注入LP仍能引起发热,表明不需PGE参与;(4)LP注入家兔POAH,使大部分热敏神经元敏感性受抑制,大部分冷敏神经元的敏感性提高,但PGE注入POAH,大部分热敏神经元不受影响,约1/2冷敏神经元也不受影响;(5)MIP-1的致热性与PGE无关。 因此,目前还难肯定PGE是EP性发热的主要介质。 (二)cAMP 脑内有较高cAMP,也有丰富的cAMP合成降解酶系。它又是脑内多种介质的信使和突触传递的重要介质,故当PGE作为发热介质有争议的同时,cAMP能否作为发热介质参与中枢机制,倍受重视。十多年前国外学者积累了一些资料,支持cAMP参与发热中枢机制,主要是:①把二丁酰cAMP给猫、兔、大鼠脑内注射,迅速引起发热;②家兔静脉内注射LP引起发热时,CSF中cAMP浓度明显增高,而环境高温引起的体温升高,不伴有CSF中cAMP增多。③注射茶碱(磷酸二酯酶抑制物)在增高脑内cAMP浓度的同时,增强LP性发热;而注射尼克酸(磷酸二酯酶激活物)则在降低cAMP浓度的同时,使LP性发热减弱。 至于LP如何引起脑内cAMP增多,最新研究资料表明,LP可能通过提高Na+/Ca2+比值,再引起脑内cAMP增多。 (三)Na+/Ca2+比值 实验表明,用生理盐水替换人工脑脊液作动物脑室灌注时,引起了猫的体温明显上升,而加入CaCl2则可防止体温上升。用等渗蔗糖溶液灌注后下丘脑,体温无变化;若加入Na+,就引起体温上升;若加入Ca2+,则可降温。因而提出体温调定点受Na+/Ca2+比值所调控,强调Ca2+浓度是调定点的生理学基础,Na+/Ca2+比值上升可致调定点上移,并确定其敏感区位于后下丘脑。 进一步实验证明,静脉内注射LP引起发热时,增加灌注脑室的人工脑脊液中的Ca2+浓度,可抑制发热效应。若把灌注液改为等渗蔗糖溶液,则静脉内注射LP不引起发热,表明LP可能通过提高下丘脑Na+/Ca2+比值,使调定点上移而启动调温反应,引起体温上升。在应用放射性同位素钠和钙的实验中发现,发热时下丘脑组织内Na+/Ca2+比值上升。
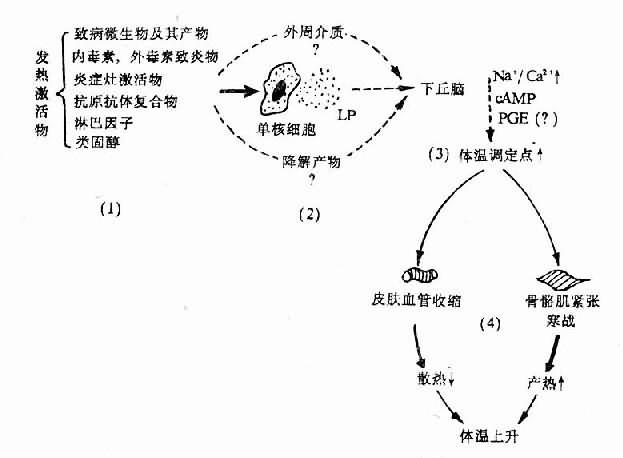
图4-3 发热发病学基本环节示意图 (未包括新发现的EP) lP如何引起Na+/Ca2+比值上升,Na+/Ca2+比值上升又如何引起调定点上移,尚缺乏深入研究。但最近国内学孝者的研究证明,用降钙剂(EGTA)灌注侧脑室引起发热时,CSF的cAMP明显增多;若事先灌注CaCl2,可使EGTA性体温升高被制止,而且CSF中cAMP的增多也明显受抑制,体温变化与cAMP浓度变化呈明显正相关。继而又发现事先给家兔侧脑室灌注CaCl2,不但抑制静脉内注射LP引起的体温上升,而且抑制了LP引起的CSF中cAMP的增多,体温变化也与cAMP浓度变化呈明显正相关。因此提出:《LP→下丘脑Na+/Ca2+↑→cAMP↑》可能是多种致热原引起发热的重要共同途径。 总之,发热的发生机制比较复杂,有不少细节仍未查明,但主要的或基本的环节已比较清楚。概括起来,多数发热发病学的第一环节是激活物的作用,但至今其作用方式所知不多;第二环节,即共同的中介环节主要是EP。后者有多种,它们可能以不同给合或先后作用于POAH,或作用于外周靶细胞,再通过发热介质参与作用;第三环节是中枢机制,无论EP是否直接进入脑内,很可能要在下丘脑通过中枢介质才引起体温调定点上移,也不排除激活物的降解产物或外周介质到达下丘脑参与作用;第四环节是调定点上移后引起调温效应器的反应。此时由于中心温度低于体温调定点的新水平,从体温调节中枢发出调温指令抵达产热器官和散热器官,一方面通过运动神经引起骨骼肌的紧张度增高或寒战,使产热增多;另一方面经交感神经系统引起皮肤血管收缩,使散热减少;由于产热大于散热,体温乃相应上升直至与调定点新高度相适应。这些基本环节可用下列模式图加以表示(图4-3)。 (责任编辑:泉水) |
第二节 发热的原因和机制(2)
时间:2006-06-19 20:32来源:大众医药网 作者:admin 点击:
329次
顶一下
(2)
100%
踩一下
(0)
0%
------分隔线----------------------------
- 上一篇:第三节 发热的时相及其热代课特点
- 下一篇:第四章 发热- -第一节 发热的概念
- 发表评论
-
- 最新评论 进入详细评论页>>