|
任何作家都会在编辑修改故事时抱怨,但改动一个词的后果通常并不严重。
但制造蛋白质的基因指令就不一样了。即使是很小的改动,也会使蛋白质无法正常工作,甚至可能造成致命的后果。只有偶尔的改变才是有益的。保持遗传指令的原样似乎是最明智的做法。除非你是章鱼。
章鱼就像生活在我们中间的外星人--它们做的很多事情都不同于陆地动物,甚至不同于其他海洋生物。它们灵活的触手能尝出接触到的东西的味道,而且有自己的思想。章鱼的眼睛是色盲,但它们的皮肤可以自行探测光线(SN:6/27/15,第 10 页)。它们是伪装大师,通过改变颜色和皮肤质地来融入周围环境或吓退对手。与大多数生物相比,章鱼能在基因指令上喷洒相当于红墨水的分子物质,其疯狂程度令人震惊,就像一个失控的编辑器。
这些编辑修改了 RNA(一种用于翻译 DNA 中存储的遗传蓝图信息的分子),而 DNA 却没有改变。
科学家们还不清楚章鱼和其他无壳头足类动物(包括乌贼和墨鱼)为什么是如此多产的编辑者。研究人员正在争论,是这种形式的基因编辑给头足类带来了进化上的优势(或触角),还是这种编辑只是有时有用的意外。科学家们还在探究 RNA 改变在不同条件下可能产生的后果。一些证据表明,编辑可能会赋予头足类一些聪明才智,但也可能以阻碍其 DNA 的进化为代价(SN: 4/29/17, 第 6 页)。
"马萨诸塞州伍兹霍尔海洋生物实验室的比较发育生物学家卡罗琳-阿尔贝汀(Caroline Albertin)说:"这些动物真是神奇。"它们有各种不同的解决方案来生活在它们来自的世界里"。RNA编辑可能有助于为这些生物提供大量的解决方案,解决它们可能面临的问题。
与其他具有两侧对称性的动物不同,章鱼不会按照预定的方向爬行。章鱼爬行的视频显示,它们可以向相对于身体的任何方向移动,而且改变爬行方向与转动身体无关。在片段中,绿色箭头表示章鱼身体的方向,蓝色箭头表示章鱼爬行的方向。
头足类如何修改其 RNA
分子生物学的核心教条认为,构建生物体的指令包含在 DNA 中。细胞将这些指令复制到信使 RNA 或 mRNA 中。然后,被称为核糖体的细胞机器读取 mRNA,通过将氨基酸串联起来来构建蛋白质。大多数情况下,蛋白质的组成符合 DNA 模板中的蛋白质氨基酸序列。
但是,RNA 编辑可能会导致与 DNA 指令的偏差,从而产生一些氨基酸与 DNA 规定不同的蛋白质。
编辑是通过化学方法修改 RNA 的四个组成模块之一,即碱基。这些碱基通常用其名称的第一个字母来表示:A、C、G 和 U 分别代表腺嘌呤、胞嘧啶、鸟嘌呤和尿嘧啶(RNA 的 DNA 碱基胸腺嘧啶)。在 RNA 分子中,碱基与糖相连;例如,腺嘌呤-糖单位被称为腺苷。
编辑 RNA 字母的方法有很多种。头足类最擅长的是一种被称为腺苷到肌苷(或 A 到 I)的编辑。当一种名为 ADAR2 的酶从腺苷(A)上剥离一个氮原子和两个氢原子时,就会发生这种情况。这种化学剥离将腺苷变成肌苷(I)。
核糖体将肌苷读作鸟嘌呤,而不是腺嘌呤。有时,这种转换不会影响蛋白质的氨基酸链。但在某些情况下,本应是 A 的地方出现了一个 G,就会导致蛋白质中插入不同的氨基酸。这种改变蛋白质的 RNA 编辑称为 RNA 重编码。
阿尔贝丁说,软体头足类动物全力拥抱 RNA 重编码,而即使是亲缘关系很近的物种在接受重写方面也比较谨慎。"其他软体动物似乎并没有达到同样的程度。
RNA 编辑并不局限于深海生物。海洋生物实验室的分子神经生物学家约书亚-罗森塔尔(Joshua Rosenthal)说,几乎每一种多细胞生物都有一种或多种 RNA 编辑酶,称为 ADAR 酶,是 "作用于 RNA 的腺苷脱氨酶 "的简称。
头足类有两种 ADAR 酶。人类也有这样的酶。"在我们的大脑中,我们编辑了大量的 RNA。我们经常这样做,"罗森塔尔说。在过去十年中,科学家们在人类 RNA 中发现了数百万个发生编辑的地方。
但这些编辑很少改变蛋白质中的氨基酸。例如,特拉维夫大学的伊莱-艾森伯格及其同事在人类 RNA 中发现了 460 多万个编辑位点。研究人员去年在《自然-通讯》(Nature Communications)杂志上报告说,其中只有 1517 个重新编码了蛋白质。在这些重新编码位点中,多达 835 个与其他哺乳动物共享,这表明进化的力量保留了这些位点的编辑功能。
RNA 编辑是如何进行的?
在一种常见的 RNA 编辑形式中,腺苷通过去除氨基并用氧(箭头)取代氨基的反应变成肌苷。图中显示的是 ADAR 酶在 "dsRNA 结合域 "附着到双链 RNA 上。酶的 "脱氨基酶结构域 "位于腺苷附近,而腺苷将变成肌苷。
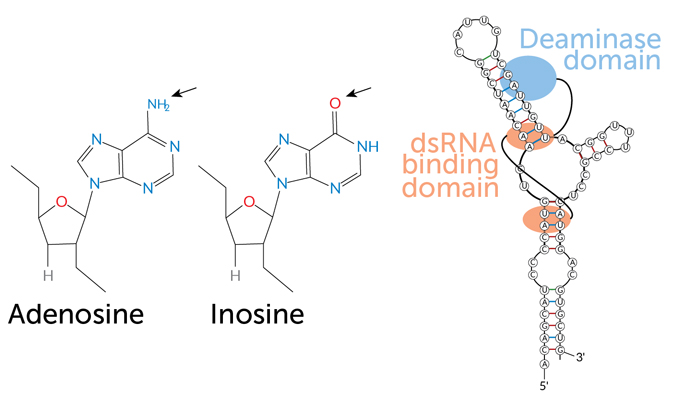
J.J.C.罗森塔尔和 E.艾森伯格/《2023 年动物生物科学年鉴》。
阿尔贝汀说,头足类动物将 RNA 重编码提升到了一个全新的水平。罗森塔尔、艾森伯格及其同事于2015年在eLife上报告说,长鳍乌贼(Doryteuthis pealeii)有57108个重码位点。此后,研究人员又对章鱼、乌贼和墨鱼等多个物种进行了研究,每次都能发现数以万计的重新编码位点。
软体头足类动物可能比其他动物有更多的编辑机会,因为至少有一种ADAR酶(ADAR2)位于细胞内。大多数动物都是在细胞核中编辑 RNA(DNA 在细胞核中储存并复制成 RNA),然后再将信息发送出去与核糖体汇合。但罗森塔尔及其同事发现,头足类动物的细胞质中也有这种酶,即细胞果冻状的内脏(SN:4/25/20,第10页)。
在两个地方都有编辑酶并不能完全解释为什么头足类的 RNA 重编码远远超过人类和其他动物。它也不能解释科学家们发现的编辑模式。
RNA 编辑可能赋予头足类灵活性
编辑并不是一个全有或全无的命题。细胞中的所有 RNA 副本都被编辑的情况很少见。更常见的情况是,一定比例的 RNA 会被编辑,而其余的则保留其原始信息。不同的 RNA 或不同的细胞或组织中,编辑的比例或频率会有很大差异,而且可能取决于水温或其他条件。阿尔贝丁及其同事去年在《自然-通讯》(Nature Communications)杂志上报告说,在长鳍乌贼中,大多数 RNA 编辑位点被编辑的比例为 2% 或更低。但研究人员也发现,有超过 205,000 个位点有 25% 或更多的时间被编辑。
在头足类动物身体的大部分部位,RNA 编辑通常不会影响蛋白质的构成。但在神经系统中,情况就不同了。在长鳍鱿鱼的神经系统中,70%的产生蛋白质的 RNA 编辑会重新编码蛋白质。加州双斑章鱼(Octopus bimaculoides)神经系统中的 RNA 被重新编码的频率是其他器官或组织的三到六倍。

长鳍乌贼在 5 万多个位置对 RNA 进行重新编码。RNA 重编码可能有助于乌贼更灵活地应对环境,但重编码是否具有进化价值尚不清楚。
艾琳-比雷尔
有些 mRNA 有多个编辑位点,可以改变 mRNA 所编码蛋白质中的氨基酸。例如,在长鳍乌贼的神经系统中,27% 的 mRNA 有三个或更多的重编码位点。有些则含有 10 个或更多这样的位点。这些编辑位点的组合可能导致细胞中产生多种版本的蛋白质。
拥有多种可供选择的蛋白质可能会让头足类 "更灵活地应对环境",阿尔贝丁说,"或者让你有多种办法解决眼前的问题"。一些研究人员认为,在神经系统中,RNA编辑可能有助于提高思维的灵活性,这可以帮助解释为什么章鱼可以打开笼子或使用工具。阿尔贝汀说,编辑可能是一种简便的方法,可以在神经系统中创建一种或多种蛋白质的版本,而在身体的其他部位则创建不同的版本。
当人类和其他脊椎动物拥有不同版本的蛋白质时,通常是由于拥有一个基因的多个拷贝。阿尔贝汀说:"一个基因拷贝的两倍、三倍或四倍拷贝会导致整个基因游乐场,让基因发挥不同的功能。但头足类动物往往不会复制基因。相反,它们的创新来自于编辑。
创新的空间很大。在乌贼体内,用于构建α-spectrin 蛋白的 mRNA 有 242 个重新编码位点。罗森塔尔和艾森伯格在今年的《动物生物科学年度评论》(Annual Review of Animal Biosciences)杂志上报告说,理论上,所有已编辑和未编辑位点的组合可以产生多达 7 x 1072 种形式的蛋白质。"研究人员写道:"为了正确看待这个数字,我们只需要说,它使自古以来生活在我们星球上的所有鱿鱼的所有细胞中合成的所有α-pectrin分子(或所有蛋白质分子)的数量相形见绌。
加利福尼亚大学圣迭戈分校的分子生物学家卡维塔-兰甘(Kavita Rangan)说,只有每个位点都是独立的,才有可能出现这种令人难以置信的复杂程度。兰甘一直在研究加州市场乌贼(Doryteuthis opalescens)和长鳍乌贼的 RNA 重编码。水温触发乌贼重新编码称为驱动蛋白的运动蛋白,这种蛋白在细胞内移动货物。
兰甘发现,在长鳍乌贼中,产生驱动蛋白-1 的 mRNA 有 14 个重新编码位点。她研究了来自视叶--大脑处理视觉信息的部分--和星状神经节的 mRNA,星状神经节是神经的集合体,参与产生肌肉收缩,从而产生水柱推动乌贼前进。
每个组织都制造了几种不同版本的蛋白质。兰甘和加州大学圣迭戈分校的萨马拉-雷克-彼得森(Samara Reck-Peterson)去年9月在bioRxiv.org上发布的预印本中报告说,但某些位点往往被编辑在一起。他们的数据表明,某些位点的编辑是协调进行的,"这有力地否定了编辑是独立进行的观点,"Rangan 说。"我们看到的组合频率与每个位点都是独立编辑的情况不符"。
连接编辑位点可能会阻止乌贼和其他头足类动物达到它们理论上能够达到的复杂性顶峰。尽管如此,RNA编辑还是为头足类提供了一种尝试多种蛋白质版本的方法,而不会被锁定在DNA的永久性改变上,Rangan说。
密歇根大学安娜堡分校的进化遗传学家张建志对这种缺乏承诺的做法感到困惑。"他说:"我觉得这说不通。"如果你想要蛋白质中的某个氨基酸,你应该改变DNA。为什么要改变 RNA 呢?
RNA 编辑有进化价值吗?
也许 RNA 编辑能带来某种进化优势。为了验证这一观点,张和当时的研究生蒋道涵比较了 "同义 "位点和 "非同义 "位点,"同义 "位点的编辑不会改变氨基酸,而 "非同义 "位点则会发生重新编码。由于同义编辑不会改变氨基酸,研究人员认为就进化而言,这些编辑是中性的。在人类中,发生重新编码或非同义编辑的位点少于同义编辑,而且被编辑的 RNA 分子的百分比也低于同义位点。
"张说:"如果我们假设同义编辑就像发生在细胞中的噪音一样,而非同义编辑的频率较低,水平也较低,这就表明非同义编辑实际上是有害的。研究人员在 2019 年发表在《自然-通讯》(Nature Communications)上的文章中指出,尽管头足类动物的重编码发生频率比人类高得多,但在大多数情况下,重编码对头足类动物来说并不是有利的,或者说是不适应的。
研究人员发现,章鱼、乌贼和墨鱼都会在少数共享位点对其RNA进行重编码,这表明重编码在这些情况下是有用的。但这只是编辑位点的一小部分。张和江发现,在某一种类头足类中被编辑而在其他种类中没有被编辑的其他几个位点也具有适应性。
如果RNA编辑并不那么有用,那为什么头足类动物在数亿年中一直坚持进行RNA重编码呢?张说,RNA编辑之所以存在,可能不是因为它具有适应性,而是因为它让人上瘾。
他和江提出了一个允许有害改变的模型(即允许对DNA进行有害改变的情况)。他说,想象一下生物 DNA 中的 G(鸟嘌呤)突变为 A(腺嘌呤)的情况。如果这种突变导致蛋白质中的氨基酸发生有害变化,自然选择就会淘汰携带这种突变的个体。但是,如果生物体偶然具有 RNA 编辑功能,那么 DNA 中的错误可能会通过编辑 RNA 得到纠正,实质上就是把 A 改回 G。
当这种情况发生时,"你就被锁定在这个系统中了,"张说。现在,生物体依赖于 RNA 编辑机器。"它不能丢失,因为你需要把A编辑回G才能生存,所以编辑将保持在高水平....,一开始你真的不需要它,但你得到它之后,你就上瘾了。"
张认为,这种编辑是中性的,而不是适应性的。但其他研究表明,RNA编辑可能具有适应性。
RNA 编辑可以作为一个过渡阶段,让生物体尝试从腺嘌呤到鸟嘌呤的转换,而不对其 DNA 进行永久性改变。2020 年,研究人员在《同行杂志》(PeerJ)上报告说,在进化过程中,一个头足类物种的 RNA 中腺嘌呤被重新编码的位点比未经编辑的腺嘌呤更有可能在一个或多个相关物种的 DNA 中被鸟嘌呤取代。对于经过大量编辑的位点,头足类动物的进化似乎更倾向于 DNA 中从 A 到 G 的转变(而不是到胞嘧啶或胸腺嘧啶,即另外两种 DNA 构建模块)。这更倾向于认为编辑是适应性的。
罗森塔尔及其同事最近研究了不同物种中 A 到 G 的替换,结果表明,与不可编辑的 A 或硬连接的 G 相比,可编辑的 A 在进化过程中是有利的。
有很多问题尚未解决
支持和反对 RNA 重编码的进化价值的证据主要来自于对不同头足类物种的总基因构成或基因组的研究。但科学家们希望直接测试重新编码的 RNA 是否对头足类动物的生物学产生影响。要做到这一点,需要一些新工具和创造性思维。
兰甘测试了乌贼运动蛋白的合成版本,发现乌贼在寒冷环境中制造的两种经过编辑的版本比未经编辑的蛋白移动得慢,但沿着称为微管的蛋白轨道移动得更远。但这是在显微镜载玻片上的人工实验室条件下。兰甘说,要了解细胞中发生的情况,她希望能在实验室培养皿中培育乌贼细胞。现在,她必须直接从乌贼身上提取组织,只能获得发生了什么的快照。实验室培育的细胞或许能让她跟踪一段时间内发生的情况。
张说,他正在通过让酵母迷上RNA编辑来测试他的允许伤害假说。贝克酵母(Saccharomyces cerevisiae)没有ADAR酶。但张建国设计了一种酵母菌株,使其携带人类版本的酶。他说,ADAR酶会让酵母生病,生长缓慢。为了加快实验速度,他使用的菌株突变率高于正常值,可能会产生G-to-A突变。但如果 RNA 编辑能纠正这些突变,那么携带 ADAR 的酵母可能比没有这种酶的酵母生长得更好。张预测说,经过许多代之后,酵母可能会对编辑上瘾。
阿尔贝汀、罗森塔尔及其同事已经开发出利用基因编辑器CRISPR/Cas9改变乌贼基因的方法。研究小组利用CRISPR/Cas9敲除或禁用了一种产生色素的基因,创造出了一种白化乌贼。阿尔贝汀说,研究人员也许能够改变DNA或RNA中的编辑位点,并测试它们的功能。
这门科学仍处于早期阶段,故事的发展可能会出人意料。尽管如此,头足类动物娴熟的编辑技术一定会让您大开眼界。
CITATIONS S. Alon, et al. The majority of transcripts in the squid nervous system are extensively recoded by A-to-I RNA editing. eLife. January 8, 2015. doi: 10.7554/eLife.05198. N. Liscovitch-Brauer, et al. Trade-off between transcriptome plasticity and genome evolution in cephalopods. Cell. Vol. 169, April 6, 2017, p. 191. doi: 10.1016/j.cell.2017.03.025. D. Jiang and J. Zhang. The preponderance of nonsynonymous A-to-I RNA editing in coleoids is nonadaptive. Nature Communications. Vol. 10, November 27, 2019. doi: 10.1038/s41467-019-13275-2. M. Moldovan, et al. Adaptive evolution at mRNA editing sites in soft-bodied cephalopods. PeerJ. Vol. 8, November 27, 2020. doi: 10.7717/peerj.10456. Y. Shoshan, et al. Adaptive proteome diversification by nonsynonymous A-to-I RNA editing in coleoid cephalopods. Molecular Biology and Evolution. Vol. 38, September 2021, p. 3775. doi: 10.1093/molbev/msab154. O. Gabay, et al. Landscape of adenosine-to-inosine RNA recoding across human tissues. Nature Communications. Vol. 13, March 4, 2022. doi: 10.1038/s41467-022-28841-4. C. B. Albertin, et al. Genome and transcriptome mechanisms driving cephalopod evolution. Nature Communications. Vol. 13, May 4, 2022. doi: 10.1038/s41467-022-29748-w. K.J. Rangan and S.L. Reck-Peterson. RNA recoding in cephalopods tailors microtubule motor protein function. bioRxiv.org. September 25, 2022. doi: 10.1101/2022.09.25.509396. J. J. C. Rosenthal and E. Eisenberg. Extensive recoding of the neural proteome in cephalopods by RNA editing. Annual Review of Animal Biosciences. Vol. 11, 2023, p. 11. doi: 10.1146/annurev-animal-060322-114534. (责任编辑:泉水) |
章鱼和乌贼是RNA编辑高手,但DNA却保持完好无损
时间:2023-08-06 21:46来源:Science news 作者:泉水
顶一下
(0)
0%
踩一下
(0)
0%
------分隔线----------------------------
- 发表评论
-
- 最新评论 进入详细评论页>>
- 推荐内容
-
- 基因编辑新工具“出炉”以RNA为目
美国科学家日前发现一种新的基于CRISPR系统的基因编辑工具,它以...
- 章鱼和乌贼是RNA编辑高手,但DNA却
任何作家都会在编辑修改故事时抱怨,但改动一个词的后果通常...
- 新疆野苹果再生及CRISPR/Cas9基因编辑
2021-07-30 新疆生态与地理研究所 【字体:大 中 小】 语音播报...
- 美国将开展首例CRISPR抗癌人体试验
据英国《自然》杂志网站、美国《麻省理工技术评论》网站近日...
- 基因编辑技术有望治疗镰状细胞病
一个美国研究小组使用CRISPR-Cas9基因编辑技术,成功修复了镰状...
- DIY基因编辑技术让你无所不能
随着越来越多的新闻媒体报道CRISPR/Cas基因编辑的应用——尤其是...
- 基因编辑新工具“出炉”以RNA为目
