|
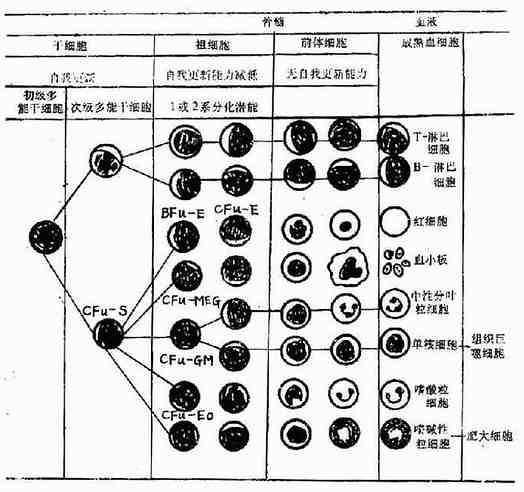
第一节 总论 造血器官 正常人体血细胞是在骨髓及淋巴组织内生成。 造血细胞均发生于胚胎的中胚层,随胚胎发育过程,造血中心转移,出生前的造血分为三个阶段:①卵黄囊造血期始于人胚第3周,停止于第9周。卵黄囊壁上的血岛是最初的造血中心。②肝造血期肝脏造血始于人胚第6周,至第4-5个月达高峰,以红、粒细胞造血为主,不生成淋巴细胞。此阶段还有脾、肾、胸腺和淋巴结等参与造血。脾脏自第5个月有淋巴细胞形成,至出生时成为淋巴细胞的器官。6-7周的人胚已有胸腺,并开始有淋巴细胞形成,胸腺中的淋巴干细胞也来源于卵黄囊和骨髓。③骨髓造血期开始于人胚第4个月,第5个月以后始成为造血中心,从此肝脾造血渐减退,骨髓造血功能迅速增加,成为红细胞、粒细胞和巨核细胞的主要生成器官,同时也生成淋巴细胞和单核细胞。淋巴结参与红细胞生成时间很短,从人胚第4个月以后成为终生造淋巴细胞和浆细胞的器官,其多能干细胞来自胚胎肝脏和骨髓,淋巴干细胞还来自于胸腺。 刚出生时全身骨髓普遍造血,5岁以后由四肢远侧呈向心性退缩,正常成人红骨髓主要见于全身扁平骨,肱骨及股骨近端骨髓中尚残留有红骨髓组织,其余为黄骨髓。黄骨髓平时无造血功能,但在生理需要时,黄骨髓、肝、脾、甚至淋巴结可恢复造血功能,称为髓外造血(extramedullary hemopoiesis)。 造血细胞生成,调控与破坏 通过脾集落的研究方法证实,现已公认各种血细胞均起源于共同的骨髓造血干细胞(hemopoietic stem cell),自我更新与多向分化是造血干细胞的两大特征。血细胞的发育共分为5个阶段:①初级多能干细胞(plu ripotent stem cell),为最原始未分化干细胞;②次级多能干细胞(mu ltipotent stem cell),部分分化,如CFU-S,淋巴性干细胞;③定向组细胞(commited progenitor cell),自我复制能力有限或消失,仅具有一系或2系分化潜能;④前体细胞(prec u rsor cell),如骨髓中形态已可辩认的各系幼稚细胞;⑤各系血细胞,成熟血细胞。 血细胞生成除需要造血干细胞外,尚需有正常造血微环境及正、负造血调控因子的存在。造血组织中的非造血细胞成分,包括微血管系统、神经成分、网状细胞、基质及其他结缔组织,统称为造血微环境。造血微环境可直接与造血细胞接触或释放某些因子,影响或诱导造血细胞的生成。 调控造血功能的体液因子,包括刺激各种祖细胞增殖的正调控因子,如促红细胞生成素(erythropoietin),集落形成刺激因子(colony-stimulating factor CSF)及白细胞介素3(IL-3)等,同时亦有各系的负调控因子,二者互相制约,维持体内造血功能的恒定,血细胞的起源与分化见(图5-1-1)
图5-1-1 血细胞起源与分化模式图 红细胞的生存时间为100-120天,因此体内每天约有1/120红细胞被破坏,6.25g血红蛋白分解,同时又有相应量的红细胞及血红蛋白生成,以保持动态平衡。红细胞的生理性破坏主要是由于衰老所致。红细胞衰老时,细胞内已糖激酶、磷酸葡萄糖异构酶等逐渐失去活力,ATP酶含量亦渐降低,因而导致依赖于能量代谢的过程产生障碍,此外磷酸已糖旁路的衰竭也导致血红蛋白结构和功能的改变。衰老的红细胞渗透脆性增加,可变形性减小,变成球形。衰老的红细胞10%在血管内破坏,但绝大部分在血管外破坏,其中脾脏起重要作用,衰老而变形性小的红细胞在脾循环中被阻留并被单核巨噬细胞所吞噬。肝脏也是破坏衰老红细胞的重要场所之一。其它器官的单核-巨噬细胞也有清除异常红细胞的能力,但效率较小。 由于骨髓造血的代偿能力为正常造血的6-8倍,当红细胞的生存时间短至10天(正常的1/12),每天约有75g血红蛋白破坏,此时红细胞破坏超过了骨髓的代偿程度,而出现贫血。由于脾脏是识别、破坏异常红细胞主要器官,因此临床上采用脾切除治疗某些溶血性贫血。 粒细胞在骨髓中成熟后即进入血液中,在循环中停留时间短,半存留期为6-7小时,然后进入组织内再重往血管内,成熟中性粒细胞存活期为9天。主要被单核-巨噬细胞破坏,亦可随各器官的分泌物排出体外。 单核细胞在骨髓中成熟后立即进入循环,其半衰期为71小时,以后进入组织成为组织巨噬细胞。 淋巴细胞可分为短寿及长寿两群,前者存活4-5天,后者经数月或数年未分裂而存活。二者功能上的意义还不清楚。淋巴细胞可在静脉-淋巴间进行循环,在其寿期内可往返循环达数百次之多。 血小板的寿命为7-10天,衰老的血小板为单核巨噬系统所清除。血小板与粒细胞不同,在骨髓中并无储备,如血小板被大量破坏,则恢复较慢,至少3-5天始能恢复正常,这正是巨核细胞成熟至产生血小板所需要的时间。 因此,当骨髓功能发生严重障碍时,首先出现的症状为粒细胞缺乏所致的感染,随之为血小板减少所致的出血倾向,最后出现贫血,而淋巴细胞减少所致的免疫功能低下则十分隐袭而且迟缓。 血液病分类 一、造血干细胞病 (一)再生障碍性贫血 (二)骨髓增生性疾病(myeloproliferative diseases)如骨髓纤维化,慢性粒细胞白血病、真性红细胞增多症,原发性血小板增多症。 (三)骨髓增生异常综合征(myelodysplastic syndrome)如难治性贫血、环形铁粒细胞性难治性贫血、慢性粒单细胞白血病等。 (四)阵发性睡眠性血戏蛋白尿。 二、红细胞病 (一)贫血 如红细胞生成和成熟障碍、DNA合成障碍、血红蛋白合成障碍、红细胞破坏过多、红细胞丢失过多等。 (二)红细胞增多症 真性红细胞增多症、继发性红细胞增多症。 三、白细胞疾病 (一)白细胞减少 各种原因所致的白细胞减少及粒细胞缺乏。 (二)白细胞增多 中性粒细胞增多症、嗜酸性粒细胞增多症,传染性单核细胞和传染性淋巴细胞增多症。 (三)白细胞质的异常 粒细胞功能异常、白血病、淋巴瘤、骨髓瘤及恶性组织细胞病。 四、出血性疾病 (一)血管壁异常 过敏性紫癜、毛细血管扩张症。 (二)血小板疾病 1.血小板减少 原发及继发血小板减少症。 2.血小板增多 原发及继发血小板增多症。 3.血小板质的异常 遗传性血小板功能缺陷,如血小板无力症、巨大血小板综合征等。继发性血小板功能缺陷,如尿毒症。 (三)凝血功能障碍 1.凝血功能低下 各种原因所致的凝血因子减少(血友病、维生素k缺乏)、血浆中抗凝物质增加。 2.凝血功能亢进 DIC早期,血栓性疾病。 血液病的诊断 一、病史采集 血液病的常见症状有贫血、出血倾向,发热或易感染,肿块、肝、脾、淋巴结肿大,骨痛等。对每一患者应了解这些症状的有无及特点。还应询问有无药物及毒物接触史,营养及饮食习惯,手术史,月经孕产史及家族史。 二、体格检查 皮肤粘膜颜色、出血点,皮肤结节或斑块,黄疸,舌乳头、浅表淋巴结,胸骨压痛,肝脾有无肿大,腹部有无肿块等。 三、实验室检查 (一)血常规及血小板计数,为最基本的化验检查。 (二)网积红细胞计数,以了解骨髓增生情况。各种红细胞平均指数的测定,对贫血患者进行形态学分类,有助于寻找贫血的原因。 (三)骨髓检查 包括骨髓穿刺涂片及骨髓活体组织检查,对某些血液病有确诊价值(如白血病、骨髓瘤、骨髓纤维化等)及参考价值(如增生性贫血)。 (四)出血性疾病 出血时间、凝血时间、凝血酶原时间、白陶土部分凝血活酶时间、纤维蛋白原定量为基本的检查。尚可做血块回缩试验、血小板聚集和粘附试验以了解血小板功能。 (五)溶血性疾病检查 常用的试验有游离血红蛋白测定、血浆结合珠蛋白测定、Rous/试验、尿潜血(血管内溶血);酸溶血试验、蔗糖水试验(PNH);渗透脆性试验(先天性球成形红细胞增多症);高铁血红蛋白还原试验(G6PD酶缺乏);抗人球蛋白试验(自身免疫性溶贫)等以确定溶血原因。 (六)细胞化学染色 对诊断急性白血病的类型有价值,如过氧化酶、碱性磷酸酶、非特异性酯酶等。 (七)活体组织检查 如淋巴结或浸润包块的活检对诊断淋巴瘤或恶性血液病的浸润有诊断价值。 (八)生化及免疫学检查 自身免疫性血液病及淋巴系统常有免疫球蛋白的异常及细胞免疫功能的异常。近年来已应用单克隆抗体对急性白血病进行免疫学分型。 (九)器械检查 如超声波、CT对纵膈及腹膜后淋巴瘤的诊断。 (十)放射性核素 应用于红细胞寿命、红细胞破坏部位测定,骨髓显像、淋巴瘤显像等。 血液学进展 近10年来,由于免疫学、生物化学、细胞遗传学及分子生物学等基础学科的进步,以及与血液病学的相互渗透,血液学也随之发生了突飞猛进的进展。 一、造血与调控 造血干细胞是生成血细胞的原始细胞。研究造血干细胞增殖、分化与调控的目的在于阐明血细胞的生成机理,并为血液病的发病机理。诊断及治疗提供科学依据。采用天然的性染色体作为细胞遗传标志,结合造血干细胞研究中的脾结节生成细胞是一类多能造血干细胞。骨髓、胎肝及外周血均可形成脾结节,证明其中均含有造血干细胞。且在临床上已应用骨髓、胎肝及外周血中的造血干细胞移植治疗急性白血病取得成功。目前正致力于提取纯化造血干细胞和开展体外造血干细胞培养扩增技术。 血细胞是在造血组织这一特定环境中由少数造血干细胞通过不断的增殖、分化而生成。在造血组织中造血微环境,尤其是间质细胞对造血干细胞的发育起重要作用,通过细胞与细胞间直接接触,以及间质细胞及其他细胞释放因子,调控血细胞的增殖活动。其中一些多肽因子受到重视,有正负增殖调控因子。目前已有基因工程产品,且陆续应用于临床。 造血增殖正调控因子应用骨髓细胞体外培养技术,证实培养液中存在负责刺激血细胞生长因子,称集落刺激因子(Colony-stimulating factor CSF)。 CSF-1:又称M-CSF,在骨髓细胞体外琼脂培养中可以诱导生成巨噬细胞组成的集落。 G-CSF:可以刺激骨髓细胞生成由粒系细胞组成的集落,已用于治疗①各种粒细胞减少症;②与抗生素联合治疗严重感染;③治疗MDS。 GM-CSF:刺激骨髓细胞生成由粒与巨噬细胞组成的集落。已用于治疗①同G-CSF;②造血功能障碍,如再障、MDS;③抗肿瘤,通过单核巨噬细胞作用。 除以上三种CSF外,还有一些造血因子是在研究T、B细胞分化中发现的,即白细胞介素(Interlukine IL),目前已知IL1-IL10,其中IL-3可以刺激骨髓细胞形成混合集落,具有多向性造血刺激作用,可治疗造血功能障碍性疾病。 (责任编辑:泉水) |
第一节 总论
时间:2006-07-22 21:45来源:大众医药网 作者:admin 点击:
825次
顶一下
(18)
100%
踩一下
(0)
0%
------分隔线----------------------------
- 发表评论
-
- 最新评论 进入详细评论页>>