|
复旦大学生物医学研究院蓝斐实验室和施扬-石雨江实验室合作发现基因活性调控新机制,有望为癌症治疗提供新思路。这项研究发现的论文发表在4月7日出版的Cell杂志上。
癌症治疗将出现新的方式。昨天,复旦大学生物医学研究院透露,蓝斐实验室和施扬-石雨江实验室合作发现基因活性调控新机制。在癌细胞中,染色质中的增强子就像癌基因的“开关”,一旦失控会过度强化附近癌基因的活性,导致细胞异常甚至癌变。研究同时发现,出现在该区域的蛋白质RACK7和去甲基化酶KDM5C可以限制此类增强子的活性,使基因表达保持在正常范围,从而抑制癌变。复旦大学生物医学研究院蓝斐昨天透露,已经和肿瘤医院联手对乳腺癌病人进行研究,结果发现恶性程度越高,增强子的活性越强。
DNA上携带着遗传信息的片段,通常被称为基因。在漫长的进化过程中,DNA序列发生着缓慢的变异以适应着环境的变化。作为遗传物质载体的染色质上还有另一种物质——组蛋白。组蛋白缠绕着DNA 链,支撑和保护着DNA。它们在稳固基因组的同时,也调控着基因的表达:通过改变相关因子的活性来改变DNA信号的释放,控制遗传数据库的输出,进而调控生物体的外在性状。
蓝斐教授笑言:“以前只知道组蛋白甲基化是基因组上的‘标签’,‘标签’可‘贴’上也可以‘撕’去,但是很多‘标签’的具体功能并不清楚。通过这些年的积累,已经知道越来越多的‘标签’是在做什么,还知道是哪些因子在什么情况下在‘贴’和‘撕’它们。”
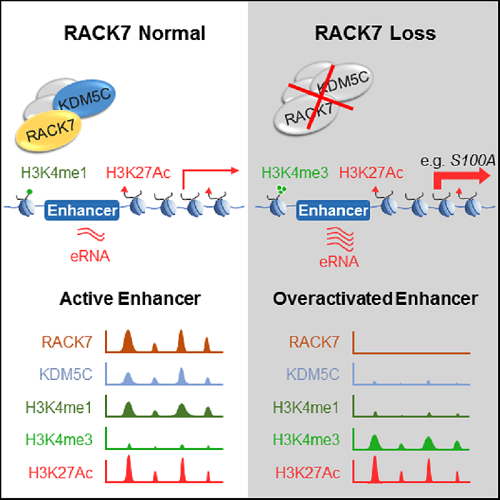
专家们发现,很多癌症病例中存在RACK7和KDM5C突变现象,无法对增强子活性进行限制,使得本应保持低活性的基因异常活化。蓝斐解释,组蛋白甲基化是一种普遍而关键的修饰形式,它的功能就像是为DNA“贴标签”,来告诉基因组一段段特定的DNA序列如何编码、有什么作用。此次研究的对象——发生在组蛋白H3第4位赖氨酸(H3K4)上的甲基化,就是用来标记该区段DNA活性的。该赖氨酸可出现多种甲基化状态,一般认为其高甲基化态(H3K4me3)出现在基因的起始区,而低甲基化态(H3K4me1)则标记着增强子区。增强子虽然本身不是基因,但是对附近基因活性调节至关重要,增强子失控可直接导致附近基因活性失控。
复旦大学的这项研究意外的发现,H3K4me3也能发生在增强子区,标记着增强子的过度活化状态,并增强附近的癌基因活性和细胞转移能力,易造成癌变。研究组顺藤摸瓜,找到了一种名为RACK7的蛋白质,它可以吸引名为KDM5C的组蛋白去甲基化酶,将原本的高甲基化状态转化成低甲基化状态,使周围的基因表达保持在正常范围,从而阻止细胞癌变。
实际上,由于改变增强子活性比改变基因序列更容易实现,因此具备极大的应用前景。
癌症,一个令社会公众谈之色变的话题,已经成为当下对人类生命健康最大的威胁之一。癌症究竟是怎样产生的?潜在的原因有很多,除了发生在DNA序列上的碱基突变,还有很多DNA之外的因素。生物学领域的科学家们对此进行了不懈探究。复旦大学生物医学研究院(IBS)蓝斐教授实验室和施扬教授-石雨江教授实验室合作,在国际生物学研究领域的最前沿取得一项新发现:在癌细胞中,染色质中的增强子失控会过度强化附近癌基因的活性,导致细胞异常甚至癌变。研究同时发现,出现在该区域的蛋白质RACK7和去甲基化酶KDM5C可以限制此类增强子的活性,使基因表达保持在正常范围,从而抑制癌变。
这项研究发现的论文将发表在4月7日出版的Cell杂志上。Cell是全世界最权威的学术杂志之一,与Nature和Science齐名,在细胞生物学、生物化学以及分子生物学等领域的研究期刊中排名第一。
基因突变并非生物体性状改变唯一原因
半个多世纪前,科学家发现了DNA(脱氧核糖核酸)作为细胞中主要遗传物质的基础,开启了分子生物学的时代。DNA上携带着遗传信息的片段,通常被称为基因。在漫长的进化过程中,DNA序列发生着缓慢的变异以适应着环境的变化。在很长一段时间里,学界依据达尔文的学说,认为生物体的性状改变是由于基因突变和自然选择造成的,这样的改变剧烈且不可逆转。
然而,真实情况下,生物体适应外部环境的速度远高于基因突变速度,这说明很多生物学现象的变化速率远高于DNA的变化频率,仅靠DNA序列本身无法完全应付外部环境的变化。事实上,作为遗传物质载体的染色质上还有另一种物质——组蛋白。组蛋白缠绕着DNA链,支撑和保护着DNA。它们在稳固基因组的同时,也调控着基因的表达:通过改变相关因子的活性来改变DNA信号的释放,控制遗传数据库的输出,进而调控生物体的外在性状。
这正是蓝斐教授和施扬教授、石雨江教授所持有的表观遗传学领域的基本观点。表观遗传学的发展提示了部分遗传信息可能保存在DNA层面之外,证明了DNA以外的因素能够调控遗传性状,从而在某些方面超越了达尔文学说的局限。
RACK7和KDM5C调控组蛋白甲基化和增强子活性,并抑制细胞癌变
蓝斐教授研究团队和施扬教授、石雨江教授研究团队的此项创新性发现,就好比在组蛋白上为基因活性找到了一个调控“开关”。
其实,组蛋白上有很多具备调控功能的开关,如组蛋白修饰。过去,学界普遍认为,组蛋白的作用就是稳定DNA,不具太多研究价值。虽然组蛋白修饰在上世纪60年代就被发现,但未引起学术界足够重视。直到90年代末,研究者发现组蛋白上的化学修饰可能具备开关功能,能够控制基因的活性,组蛋白修饰的重要性才因此被确认。
组蛋白甲基化是一种普遍而关键的修饰形式,它的功能就像是为DNA“贴标签”,来告诉基因组一段特定的DNA序列如何编码、有什么作用。此次研究的对象——发生在组蛋白H3第4位赖氨酸(H3K4)上的甲基化,就是用来标记该区段DNA活性的。该赖氨酸可出现多种甲基化状态,一般认为其高甲基化态(H3K4me3)出现在基因的起始区,而低甲基化态(H3K4me1)则标记着增强子区。增强子虽然本身不是基因,但是对附近基因活性调节至关重要,增强子失控可直接导致其附近基因活性失控。
复旦大学的这项研究意外的发现,H3K4me3也能发生在增强子区,标记着增强子的过度活化状态,并增强附近的癌基因活性和细胞转移能力,易造成癌变。研究组顺藤摸瓜,找到了一种名为RACK7的蛋白质,它可以吸引名为KDM5C的组蛋白去甲基化酶,将原本的高甲基化状态转化成低甲基化状态,使周围的基因表达保持在正常范围,从而阻止细胞癌变。
增强子活性调控机制可应用于癌症治疗
据蓝斐教授介绍,这项研究早在2011年就已启动,起初进展并不顺利,“这个RACK7蛋白像是藏于通幽曲径之中,我们知道那背后是壮丽的奇景,但始终不能得窥门径”。直到2014年初,本论文的共同第一作者生物医学研究院博士后沈宏杰和博士生徐文绮同学意外的发现“增强子过度活化态”并证明其与RACK7之间存在关联,这才“摸准了脉”,之后的研究也水到渠成。
实际上,由于改变增强子活性比改变基因序列更容易实现,因此具备极大的应用前景,它已成为近年来表观遗传领域的一项研究热点。只是在这项新发现以前,学界未意识到H3K4的甲基化动态变化发生在增强子上,因而并未发现该调控的具体机制。
值得一提的是,复旦-哈佛双聘教授施扬正是组蛋白去甲基化领域的奠基人和开拓者之一。早在2004-2007年间,他与当时还在其实验室开展研究的石雨江博士后和蓝斐博士在国际上发现了首例组蛋白去甲基化酶LSD1和其它多类去甲基化酶,包括本项研究涉及到的KDM5C。去甲基化酶的发现,不仅证明了组蛋白甲基化是可逆的,也为甲基化修饰参与基因活性的动态调控奠定了理论基础。
12年后,蓝斐教授研究团队和施扬教授、石雨江教授研究团队的这项发现,又将该领域的研究向前推进了一步。蓝斐教授笑言,“那时候只知道组蛋白甲基化是基因组上的‘标签’,‘标签’可‘贴’上也可以‘撕’去,但是很多‘标签’的具体功能并不清楚。通过这些年的积累,已经知道越来越多的‘标签’是在做什么的,还知道是哪些因子在什么情况下进行‘贴’和‘撕’它们的了。”
从去年夏天投稿到今年1月稿件被初步接受,前后不到5个月时间,这是非常难得的,足以体现Cell杂志对这项研究的重视。
这项发现,不仅发现了表观遗传修饰对基因组信息进行自我调节的新规律、提出了“增强子过度活化态”理论,更重要的是它潜在的医疗价值:很多癌症病例中存在RACK7和KDM5C突变现象,无法对增强子活性进行限制,使得本应保持低活性的基因异常活化。如今这一机制被揭示,不仅对癌症发生提供了一种新的理论解释,更可为癌症的个性化治疗提供新的药物靶点和治疗思路。
文/方艾青
附:关于复旦大学生物医学研究院和表观遗传重点实验室
复旦大学生物医学研究院(IBS)创立于2005年,设有分子细胞生物学、表观遗传学以及医学系统生物学三大研究中心,科研成果的产出能力逐年上升,已经达到国际一流研究平台水平。十一年来,研究院已经形成以十余名院士和国际知名科学家为核心,二十多名核心PI与优秀研究人员为骨干的强大科研团队,在生物医学研究领域不断探索,尤其是近几年来,在表观遗传和肿瘤代谢方面涌现了大量优秀的研究成果,发表在Cell、Nature、Science等国际顶级期刊中,成就在业内可称瞩目。
表观遗传学中心是由施扬和石雨江两位复旦-哈佛大学兼职教授在2007年创建,旨在针对若干重大疾病的发病分子机制、治疗靶点及相关药物,开展表观遗传的基础和临床应用研究,特别是针对表观遗传学最前沿领域的组蛋白修饰识别、DNA甲基化动态调控、非编码RNA的作用机制、及细胞身份转换的表观遗传机制开展原创性研究。借助复旦大学和IBS学院灵活的双聘机制,协同基础医学院、附属儿科医院和肿瘤医院等院系,引进了如徐彦辉、于文强、文波、蓝斐、何祥火、李大强等一批高层次的海外人才加盟,研究实力日益壮大,并于2014年3月入选上海市教委“上海高校重点实验室建设计划”。 (责任编辑:泉水) |
基因活性调控新机制为癌症治疗提供新思路
时间:2016-04-11 14:29来源:解放网 作者:未知 点击:
100次
顶一下
(0)
0%
踩一下
(0)
0%
------分隔线----------------------------
- 发表评论
-
- 最新评论 进入详细评论页>>
- 推荐内容
-
- 科学家在临床研究中开发出可杀死
美国最大的癌症研究和治疗机构之一希望之城(City of Hope)的研...
- 研究利用人体自身免疫细胞对抗脑
胶质母细胞瘤是最常见也是最致命的脑癌,它生长迅速,侵袭并...
- 科学家发现对50%癌细胞有效的细胞
斯坦福大学的科学家们发现了一种诱导癌细胞死亡的方法,这种...
- 超声波可能协助化疗药物通过血脑
破解脑癌治疗的密码可能要从破解大脑的保护罩开始。 大脑的大...
- 2018或将开启中国肿瘤免疫治疗新元
NGS作为一项重大的技术突破,从2010年前后开始肿瘤治疗的临床转...
- 新方法可提前诊断乳腺癌
癌症早期诊断对治疗非常重要。英国伦敦大学学院近日发表一项...
- 科学家在临床研究中开发出可杀死