|
图片来源:Science 在10月25日发表的题为《Structural basis of latent TGF-β1 presentation and activation by GARP on human regulatory T cells》的论文中,研究人员阐明了抑制免疫反应的细胞中一组蛋白质的三维结构。同时,研究还发现了一种能够阻断这些蛋白质互相作用及其诱导的免疫抑制(immunosuppression,癌细胞“自保”的一种机制)反应的抗体药物。该抗体能够在癌症患者中刺激对抗肿瘤细胞的免疫力,从而触发免疫细胞攻击肿瘤,发挥抗癌作用。 调节性T淋巴细胞(regulatory T lymphocytes,Tregs)是一种免疫抑制细胞,通常的作用是抵消过度的免疫反应,预防自身免疫性疾病。然而,在癌症患者中,Tregs却是有害的:抑制对抗肿瘤细胞的免疫反应。具体来说,Tregs是通过产生一种名为TGF-β的蛋白质来发挥作用。该蛋白质会将抑制信号传递给邻近的免疫细胞,特别是癌症患者中那些被认为能够摧毁肿瘤的免疫细胞。
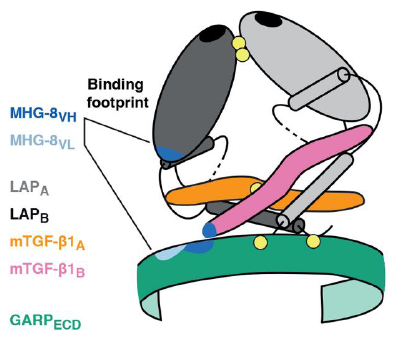
Credit University of Alberta Tregs产生TGF-β的方式是复杂的。3年前,de Duve研究所的Sophie Lucas教授及其团队发现,TGF-β是通过Treg表面上一种名为GARP的蛋白质释放出去的。此外,他们还发现,用特定的抗体能够阻断GARP释放TGF-β。那么,GARP是如何调节TGF-β产生的?抗体又是如何阻断TGF-β释放的呢? 为了解决这些问题,Sophie Lucas与根特大学的Savvas Savvides教授团队建立了合作,以期弄清由GARP和TGF-β组成的蛋白质复合物的三维结构。 具体来说,研究人员使用了X射线晶体学,这种方法被用于研究分子结构已有一个多世纪了。然而,他们面临的实际问题是,无法轻易获得GARP和TGF-β蛋白质复合物的晶体。如何解决这一问题呢?科学家们决定使用一种阻断性抗体来稳定复合物的结构,这种方法不仅有助于产生适合用于结构测定的合适晶体,还能够提供治疗性抗体如何发挥作用的细节。
图片来源:Science 最终,研究人员发现,GARP就像一个马蹄铁,TGF-β“跨坐”(straddled)在上面。而抗体片段是结合在TGF-β和GARP两个蛋白上的。它的作用似乎是将TGF-β和GARP两个分子黏在一起,以确保当其它分子想将它们分开时,TGF-β不会被“拉走”(即,释放出来),从而阻止TGF-β释放帮助肿瘤生长的抑制信息。 Sophie Lucas教授说:“弄清GARP-TGF-β-抗体这一复合物的结构展示了阻断TGF-β活性的可能性。未来,科学家们有望基于这一发现,设计出一种精确的方法来治疗与TGF-β或Treg活性相关的疾病,尤其是用于癌症治疗的免疫疗法。” (责任编辑:泉水) |
厉害了!斩获诺奖后,免疫疗法新突破再登Science
时间:2018-10-31 15:10来源:网络整理 作者:金森 点击:
180次
顶一下
(0)
0%
踩一下
(0)
0%
------分隔线----------------------------
- 发表评论
-
- 最新评论 进入详细评论页>>
- 推荐内容
-
- 早年的精神压力比头部受伤改变更
由俄亥俄州立大学 图片来源:Pixabay/CC0 公共领域 当研究人员开...
- 美国国会证实不明飞行物和“非人
黑衣人在本世纪似乎一直在加班加点地工作。如果他们是真的(...
- 实验室人类胚胎模型揭示生命开始
新近报道的一些在实验室培养皿中生长的细胞团被誉为科学家在...
- 脑电波可以在大脑间传播
欧洲科学家通常一次研究一个大脑。例如,他们观察当一个人阅...
- 细胞移植可以使大脑返老还童
摘要:一项有前景的研究表明,移植的健康神经胶质细胞可以在...
- 科学家们找到了十亿年前的地球上
生长在塔斯马尼亚岛西海岸的Tarkine雨林的异常的橙色真菌,澳大...
- 早年的精神压力比头部受伤改变更