|
启动子渗漏表达加重细胞的代谢负担,使得细胞无法正常生长,影响产物的生产。于是降低启动子的渗透表达成为提高表达目标蛋白产量的一大策略,本研究就是围绕这个主题展开。
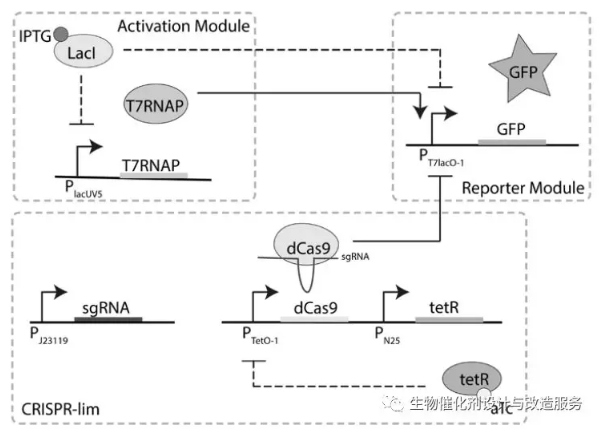
本研究以目前表达蛋白常用的pET系统为研究靶标。所谓的pET系统就是将目标蛋白基因至于T7启动子的控制下,该启动子与ATG之间插入了一个乳糖操纵子操纵区域,该启动由T7RNA聚合酶识别并其实转录,期转录效率是大肠杆菌内源的RNA聚合酶的8倍左右。现在常用BL21(DE3)作为蛋白表达的宿主,由于λDE3噬菌体侵入BL21中,导致λDE3噬菌体中的T7RNA聚合酶基因插入到BL21基因组中形成了BL21(DE3)宿主。将表达有目标蛋白基因的pET载体导入BL21(DE3)中,向培养基中加入诱导剂IPTG,诱导基因组上的T7RNA聚合酶表达,继而诱导pET载体上目标蛋白的表达。 即使pET具备双重控制蛋白的表达水平,但是由于T7RNA聚合酶有lacUV5启动子且T7RNA聚合酶转录的高效,导致微弱的T7RNA聚合酶表达(由于培养大肠杆菌的LB培养基中含有乳糖)也能促使目标蛋白本底表达很高,于是用这种系统表达某些毒性蛋白受到限制。基于这些,控制T7RNA聚合酶的渗漏表达很有必要。本研究在不改变启动子序列、结合特性以及长度等特征,利用CRISPRi技术靶向pET载体上的lac操纵区域,近一步阻碍了T7RNA聚合酶起始转录,明显降低了蛋白的渗漏表达,见1A。
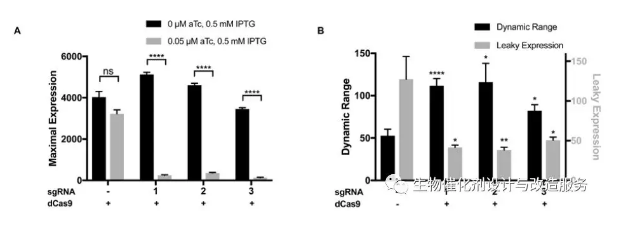
图1 表达有CRISPR-lim系统的菌株和野生型菌株GFP表达的对比 利用以上思路,本研究开发了CRISPR-lim系统,该系统由两个质粒构成,一个质粒表达dCas9蛋白,至于无水四环素诱导型启动子的控制下,另一个质粒则组成型表达sgRNA。实验证明,利用CRISPR-lim系统能够增大目标蛋白表达最低水平和最大表达水平的差值的差值(由于渗透表达被CRISPR-lim系统抑制)(见图1B),并保持最大表达量在野生型的基础上不变。同时研究者利用该系统来调控pET载体上PT7/lacO1+25位置带有由T到G的突变(该位置的突变使得T7RNA聚合酶和启动子之间的亲和力更强)的渗漏表达情况,结论也跟之前一致。同时研究证明,该系统可使细胞免受毒性蛋白的渗漏表达带来菌体生长不健康等问题。 (责任编辑:泉水) |
CRISPRi降低pET系统渗漏表达水平
时间:2018-01-03 10:32来源:生物催化剂设计与改造服务 作者:未知 点击:
198次
顶一下
(0)
0%
踩一下
(0)
0%
------分隔线----------------------------
- 发表评论
-
- 最新评论 进入详细评论页>>
- 推荐内容
-
- 体生长抑素信号在大脑中的作用
作者:宾夕法尼亚州立大学 Sam Sholtis 新研究表明,由大脑中许多...
- 协和发现国内首例“阴性艾滋病患
HIV抗体检测为常见的艾滋病筛查手段,阳性一般意味着感染,阴...
- 研究发现:月圆之周自杀死亡人数
作者:印第安纳大学医学院 图片来源:Pixabay/CC0 公共领域 几个...
- 大脑图像的清晰度提高了 6400 万倍
杜克大学 超级强大的核磁共振成像与光片显微镜相结合,使研究...
- 研究发现:保持免疫复原力的人更
作者:德克萨斯大学圣安东尼奥健康科学中心 Sunil Ahuja、Muthu ...
- 大脑如何检测和调节炎症
牛奶经过微生物发酵成为酸奶以后,其中的营养成分和营养价值...
- 体生长抑素信号在大脑中的作用