|
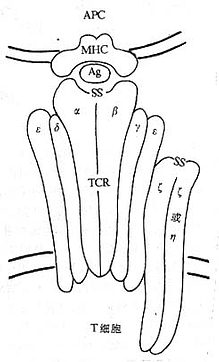
[超搞原]有的抗原不经过APC处理和递呈可直接激活CD4阳性T细胞称为超抗原(superantigen,SAg),具有类似致分裂原的作用。SAg对T细胞的激活采取一种独特的方式,即分子一端和TCRβ链上V基因产物结合,别一端和APC表面MHCⅡ类分子相结合。因此SAg发挥作用需有两类细胞:表达TCRβ链的CD4+T细胞和表达MHCⅡ类抗原的辅佐细胞。外源性的SAg主要是葡萄菌、链球菌、支原体等微生物产生的毒素,其中以葡萄球菌肠毒素A(Staphylococcus enterotoxin A,SEA)研究得最多,SEA往往取用特定TCR基因片段Vβ6.9及Vβ22,SEA另一侧与HLA-DR分子β1结构域的α螺旋相结合。 SAg激活CD4+T细胞使之释放IL-2,IFN、TNF等细胞因子,诱导CTL分化为效应细胞,可杀伤对NK、LAK高度抵抗的白血病细胞。 (二)CD3(T3、Leu4) CD3分子分布于成熟T淋巴细胞表面,至少由γ、δ、ε、ζ、η5种多肽链组成,与T细胞抗原受体非共价连接(图1-3)。CD3单克隆抗体可诱导CD3多肽和TCR共帽形成(co-capping),并诱导T淋巴细胞活化。TCR识别外来抗原与自身MHC分子形成的复合物,CD3对于信号的传递具有重要作用。
图1-3 TCR/CD3结构模式图 T细胞在胸腺发育过程中,CD3γ、δ和ε基因的表达要早于TCRα、β链基因的表达。CD3γ、δ和ε基因产物通过翻译后的修饰形成核心结构,在内织网处,此核心结构与TCRαβ异源双体形成复合物后转移到高尔基氏体,进行N连接的糖基化。ζ-ζ同源双体与TCRαβ/CD3γδεε结合后组成一个完整的复合物TCRαβ/CD3γδεεζζ(少娄分子为TCRαβ/CD3γδεεζη)。最近发现一个分子量为28kDa的ω连或T细胞受体相关蛋白(t cell receptor associated protein,TRAP),可能具有控制TCR/CD3复合物在内织网中装配和转移的功能,但确切的机理尚不明了。ω链不表达于细胞膜表面。
图1-4 TCR/CD3复合物模式图 1.CD3γ、δ和ε链 CD3γ、δ和ε链基因有高度的同源性,在人类位于第11号染色体,小鼠9号染色体,这三种链的基因可能从一个祖先基因通过基因复制而来。CD3γ、δ和ε链在细胞膜外都有一个Ig样结构域(C2),都属于免疫球蛋白超家族,但不存在多态性或可变性,因此不直接参与特异性识别抗原。γ、δ和ε链的穿膜部分含有带负电谷氨酸和/或天冬氨酸残基,这与TCRα、δ链穿膜区中带正电赖氨酸、精氨酸以及β、γ链穿膜区中的赖氨酸相互作用有重要作用。γ、δ和ε链胞浆部分含44到81氨基酸残基,提供了把信息传导到细胞内的条件。γ链分子量为25~28kKa,有2个糖基化点,氨基端89个氨基酸残基为亲水性,组成胞膜外区,穿膜区含27个氨基酸残基,胞浆内区44氨基酸残基,胞浆内113位丝氨酸残基可能是磷酸化位点。δ链分子量为20kDa,含有2个糖基化点,胞浆内126位丝氨酸可能是磷酸化位点。CD3δ链抗体能非特异性地活化T细胞,促进T细胞有丝分裂。ε链分子量为20kDa包括氨基端104亲水氨基酸的胞膜外区,穿膜区26个氨基酸残基,胞浆内区81个氨基酸残基。目前所制备的单克隆抗体中大部分是针对CD3ε链。 2.CD3ζ和η ζ(zeta)和η(eta)链结构相似,而与CD3γ、δ和ε链无同源性。ζ和η链分子量分别为16kDa和21kDa,它们的胞膜外以及穿膜区和结构相似,但有胞浆区不同。胞膜外区很短,只有9个氨基酸残基,含有半胱氨酸,ζζ之间或ζη之间形成二硫键。ζ和η链穿膜部分各有一个带负电的天冬氨酸。ζ和η链胞浆内区分别有113个和155个氨基酸残基,具有多个酪氨酸磷酸化的位点。最近研究证实,CD3ζ链可能与NK细胞上Fcγ受体相连。此外,ζ链与FcεRⅠγ亚单位有很高的同源性。 CD3γ、δ和ε链是单链,而ζ则以ζ-ζ同源双体存在于80~90%T细胞中,有10~20%T细胞则以ζ-η异源双体存在。因此最常见的TCR/CD3复合物的组成形式是TCRαβ/CD3γδεεζζ。 在体外,抗CD3McAb可促进T细胞表达IL-2R,产生IL-2、TNF-α、TNE-β、IFN-γ和IL-4等多种细胞因子,诱导非MHC限制的细胞毒作用,增强T细胞、LAK和NK细胞的杀伤肿瘤作用。 1986年美国FDA已批准应用小鼠抗CD3 McAb治疗急性肾移植排斥反应。CD3McAb治疗心、肝移植排斥反应已完成Ⅲ期临床试验,正申请投放市场。 (三)CD4 CD4和CD8分子分别与MHCⅡ类和Ⅰ类抗原结合,不仅可增强T淋巴细胞与APC或靶细胞结合的程度,而且与刺激信号的传递有关。CD4阳性细胞是MHCⅡ类抗原限制的细胞群,CD8阳性细胞是MHCⅠ类抗原限制的细胞群。有关CD4和CD8抗原在胸腺细胞分化过程中的变化以及CD4、CD8T细胞亚群见第七章“淋巴细胞群及其亚群”。 1.CD4分子的结构 为细胞膜表面单链糖蛋白,人CD4分子由458个氨基酸残基组成,包括信号肽23氨基酸残基,胞膜外区374个氨基酸残基,含2个糖基化点,穿膜区21氨基酸残基,胞浆内区含有40氨基酸残基。胞膜外区具有4个IgV样结构域,属免疫球蛋白超家族成员。
图1-5 CD4分子结构模式图 第一个V样区与Igκ链的V区有很高同源性,有3个互补决定区(complementarity-determining region, CDR)。其余3个V样区功能区与Poly IgR的同源性最接近,其中第2和4个V样区中两个半胱氨酸的距离分别为28和42个氨基酸残基,第3个V样区无二硫键。CD4跨膜区与MHCⅡ类分子β链的跨膜区高度同源。编码人CD4基因位于第2号染色体,小鼠第6号染色体,小鼠CD4分子的分子量为55kDa,由457个氨基酸残基组成,信号肽有22个氨基酸残基,N端功能区110个,胞膜外还有一个长序列(long sequence)的区域,含262氨基酸残基,有4个糖基化点,穿膜区25氨基酸残基,胞浆内区含38个氨基酸残基。人和小鼠CD4分子约有55%序列相同,尤以胞浆内区为显。在胞浆部位有3个丝氨酸残基,可能作为PKC磷酸化的底物。CD4胞浆部分功能区高度的保守性表明这一区域的功能是重要的。 2.CD4分子的分布 分布于部分T淋巴细胞和胸腺细胞表面,也发现于某些B淋巴细胞、EBV转化和B细胞、单核吞噬细胞和脑细胞。在人类,OKT4和Leu3McAb可检测CD4抗原。小鼠L3T4是人OKT4的类同物。 3.CD4分子的功能 在成熟的胸腺细胞、外周血和周围淋巴器官中,CD4阳性细胞一般为辅助性T淋巴细胞诱导细胞/抑制性T淋巴细胞诱导细胞(helper inducer/suppressor inducer)。 (1)作为细胞与细胞之间的粘附分子:CD4第1、2功能区与MHCⅡ类分子的非多态部分结合以稳定MHCⅡ类分子限制的T细胞与带有MHCⅡ类分子与抗原复合物的APC细胞相互作用。抗CD4McAb可封闭T细胞的辅助活性。 (2)转导信号:CD4分子胞浆区与蛋白酪氨酸激酶p56lck相联,对T细胞信号的转导起重要作用(详见第八章)。 CD4分子胞膜外第1个结构区域是HIV外壳蛋白gp120的识别部位,其中CDR2与gp120结合的亲合力最高,CDR3可能与HIV感染靶细胞膜融合有关。可溶性 gp120结合到CD4的反应可被下列试剂所阻断:(1)针对CD4V1区中CDR2、CDR3的McAb;(2)CDR2、CDR3肽段;(3)可溶性CD4 V1肽段;(4)抗gp120抗体。HIV感染机体可引起选择性CD4+细胞的数量减少和功能降低,主要通过以下不同的机理:(1)HIVgp120与T细胞表面CD4分子结合后通过病毒芽生破坏细胞膜,在感染细胞浆内产生大量非整合的病毒RNA直接损伤细胞膜、干扰细胞代谢,影响CD4分子在细胞膜上的表达以及形成短命的合胞体;(2)阻断CD4+T细胞与Mψ细胞表面MHCⅡ类抗原的结合,影响Th细胞对抗原的识别过程;(3)产生抗体损伤CD4细胞,机体产生抗gp120或其他HIV成份的抗体,通过激活补体或ADCC效应损伤CD4阳性细胞;(4)特异性CTL也可通过识别CD4细胞表面的gp120分子而杀伤CD4阳性细胞。最近发现,CD26可能是HIV的另一类受体。 应用基因工程生产的重组可溶性CD4(rsCD4)治疗ARC(AIDs related complexes)、艾滋病正在进行Ⅱ期临床试验;抗CD4McAb(Leu3a)也已开始治疗HIV感染的I期临床试验。此外,应用CD4-IgG、CD4-PE(绿脓杆菌外毒素)、CD4-RA(蓖麻毒毒A)等杂交分子杀伤HIV感染的T细胞,作为抗爱滋病的新药也已进入临床验证。1991年美国风湿病学年会上报道了用抗CD4McAb治疗类风湿性关节炎(RA),经治疗后临床症状明显改善,PBMC中CD4阳性细胞的比例和CD4抗原密度明显下降,血清可溶性CD4(sCD4)水平明显升高,血沉、CRP、RF、和总免疫球蛋白水平明显降低。抗CD4嵌合抗体(Centocor公司)治疗类风湿性关节炎、多发性硬化症也已进入Ⅱ期临床验证。抗CD4McAb(Ortho Biotech公司)预防器官移植排斥反应已开始临床验证。 (四)CD8 1.CD8分子的结构 CD8分子是由α、β两条多肽链组成的穿膜糖蛋白,α链分子量34kDa,相当于小鼠的Lyt-2;β链30kDa,相当于小鼠的Lyt-3。每条链各包括1个IgV样结构域、连接肽、穿膜区和胞浆区。α和β链在连接肽处有二硫键相连。部分CD8分子是由同源α链双体(α/α)组成,如在CD8阳性的TCRγδT细胞表面。有报道胸腺细胞上的CD8可能为四聚体。CD8α和β链IgV样区约含110氨基酸残基,与Igκ、λ轻链的V区有30~35%同源性,与V有20~22%同源性,与TCr Vα和Vβ有24%同源性。编码CD8α、β链的基因属Ig基因超家族成员,与编码Igκ链基因密切连锁,定位于第2号染色体,表达前不需要重排。编码小鼠Lyt-2和Lyt -3基因定位于第6号染色体,各有二个等位基Ly2a、Ly2b和Ly3a、Ly3b,分别编码Lyt-2.1、Lyt-2.2和Lyt-3.1和Lyt-3.2。
图1-6 CD8分子结构模式图 2.CD8分子的分布 分布于部分T淋巴细胞和胸腺细胞。在异基因骨髓移植病人中可出现TCRγδCD8α/α表型的T细胞。NK细胞表面的CD8分子为α/α二聚体。 最近发现,通过细胞分泌或/和胞膜外分子脱落的机制,在血清中存在着可溶性CD8分子(sCD8)。白血病、何杰金氏病、艾滋病、急性传染性单核细胞增多症、再生障碍性贫血、同种异体移植、类风湿性关节炎和全身性红斑狼疮等患者血清中sCD8水平增高,其升高的水平与疾病的严重程度、病情变化、治疗反应以及预后有较密切的关系。 3.CD8分子的功能 (1)作为细胞与细胞间的附粘分子MHCⅠ类抗原是CD8分子的配体。CD8分子与MHCⅠ类分子结合可以稳定MHCⅠ类分子限制的T细胞(主要是CTL)与带有MHCⅠ类分子与抗原复合物的靶细胞结合。CD8阳性细胞为抑制性T淋巴细胞/杀伤性T淋巴细胞(suppressor T lymphocyte/cytotoxic T lymphocyte,Ts/Tc)。T8、Leu2 McAb识别CD8α链,可封闭Tc的活性。 (2)转导信号,目前发现CD8也与蛋白酪氨酸激酶p56lck相关。在T细胞增殖和分化的信号转导中起重要作用。 抗CD8McAb可预防骨髓移植时移植物抗宿主反应,美国Becton-Dicknson公司生产Leu2已进入Ⅱ期临床验证。 (五)CD2 1.CD2分子的结构和分布 CD2分子又称T11、绵羊红细胞受体(ER)、淋巴细胞功能相关抗原2(LFA-2)和Leu5,是人T淋巴细胞表面的单链糖蛋白,分子量50kDa,CD2基因定位于第1号染色体,属免疫球蛋白基因超家族。编码351氨基酸残基,包括先导序列24氨基酸残基,2个胞外功能区(C2)共185氨基酸残基,有3个糖基化位点,穿膜区和胞浆部分分别为26和116个氨基酸残基,胞浆区富含肺氨酸和碱性氨基酸,胞浆区与活化信号的传递可能有关。在DNA水平上人和小鼠CD2有51%同源性。CD2分子分布于95%的T细胞、50~70%胸腺细胞和大颗粒淋巴细胞(LGL/NK)。 (责任编辑:泉水) |
第二节 白细胞分化抗原的应用(2)
时间:2006-06-29 00:12来源:大众医药网 作者:admin 点击:
484次
顶一下
(19)
100%
踩一下
(0)
0%
------分隔线----------------------------
- 上一篇:二、与B细胞识别、粘附、活化有关的CD分子
- 下一篇:二、小鼠白细胞分化抗原
- 发表评论
-
- 最新评论 进入详细评论页>>