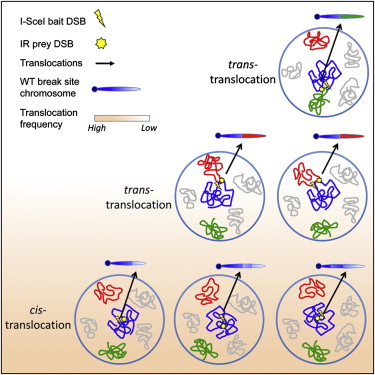
我们的染色体能断裂并改组它们自己的片段不是什么新鲜事,几十年来科学家们已经认识到这一点,尤其是在癌症细胞中。对染色体在哪里可能断裂及断裂片段如何集合在一起的规律只在现在才刚刚被了解。波士顿儿童医院和免疫疾病研究所(IDI)的研究人员已经帮助将这些规律带入更清晰的焦点中,通过发现细胞核内位于染色体上基因组的成千上万基因中每一个对断裂染色体末端在哪里再结合有巨大影响,尤其是基因组三维结构组织。这种知识可以揭示癌症和正常细胞功能如免疫力有关的基本过程。 这项研究由波士顿儿童医细胞与分子医学计划和马萨诸塞大学医学院系统生物学计划的科学家共同主持开展,研究结果发表在2月16日的期刊Cell上。 在癌细胞中,染色体重组或易位过程被DNA直链生理断裂与交叉所标记,常导致新癌症启动融合基因的创造。类似地,当天然B细胞开始首次产生抗体时,它通过抗体多样性的正在断裂和重组基因建立它的靶向选择。然而,染色体断裂与易位是许多癌症的基础,历史上没有系统地研究它们如何被产生的方法。约5年前,开展此研究的研究团队着手产生一种高通量方法来阐明这个癌症生物学上的重要问题。 为了达成这个目标,Alt实验室开发了高通量全基因组易位测序法(HTGTS,即绘制出基因组上更可能出现的染色体断裂与易位的"热区")和一个以前认为不可能的分辨率水平。在早期的HTGTS研究中,他们发现断裂染色体经常自我重排,与横过不同染色体的共享片段相反。 为了更深入探讨这些研究发现,他们将HTGTS与一种称为Hi-C的方法结合。Hi-C方法由Job Dekker研究团队开发,它测量所有基因组序列相对于另一个在三维空间上是怎样被组织安排的。 这种结合数据揭示了基因组组织如何支配染色体重排的几个相关但不同的原理。第一个是基于每一个细胞相对于它的邻近细胞如何组织自己基因组的细微区别(指的是细胞基因组组织空间异质性)。尽管基因组以一种绝大部分细胞所共有的模式被组织,单个细胞则包含着小偏差。这后一特点让一小部分子细胞内许多基因生理上接近彼此,即使在大部分细胞中它们也不接近彼此。 第二个涉及近似性。如果两个断裂染色体链在给定细胞核的三维空间内存在紧密的近似性,它们更可能彼此连接。这一发现对于涉及不经常断裂的DNA序列的易位特别重要,象这样的那些涉及易位的则发现于各种非淋巴肿瘤中。 第三个是应用前两个到不经常断裂的DNA序列中(例如B细胞发育期间驱动抗体基因重排的那些)。这样的序列往往与相同搭档序列一起改组,其中搭档序列是在那些生理上互相接近的子细胞中,即使是许多细胞内搭档序列不接近。这能加速象许多淋巴肿瘤中观察到的一样的复发易位。 总的来说,这些原理强调近似性、基因组组织与断裂频率之间的关系。两个序列连接必须是断裂的和生理近似的。如个2个序列在大部分细胞中是一起的并经常断裂,它们在许多细胞中将易位。如果它们常在一起但其中一个不断裂,或者如果它们都断裂但总是位于细胞核的相对侧,它们易位的可能性非常低或者为零。但是,如果2个序列经常断裂并在子细胞中很接近,它们在那样的子细胞中将经常易位,这有助于复发性易位。 断裂染色体片段与相同染色体而不是其他染色体内的其他片段连接的可能性更高,其他染色体上生理学上更远的片段可能与癌症基因组有巨大关联性。例如,引起断裂的癌症治疗可能更偏向于引起染色体间重排。这也可能与"染色体乱序"(chromothripsis)有关,其中染色体乱序是一种最近揭示的现象,即许多癌症中一个染色体的序列变得杂乱。 对染色体易位中生理空间近似性与总三维基因组结构作用的新了解为解码细胞核以怎样方式被组织影响基因组混乱开辟了新道路,其中基因组混乱发现于癌症和以染色体重组为特点的其他疾病中。这项研究也指出了为研究细胞核内组织性设计如何影响基本生物学过程而联合2种高通量基因组测定法Hi-C和HGTGS的威力。这种方法的应用将提供观察许多不同类型癌症基因组的一个新透镜。 这项研究由如下机构支持:美国国家癌症研究所、美国国家人类基因组研究所、霍华德休斯医学研究所、白血病和淋巴瘤协会、W.M. Keck基金会、癌症研究所与德国国家卓越基金会。 doi:10.1016/j.cell.2012.02.002 |
Cell:看基因组3D结构 了解染色体改组
时间:2012-02-22 11:23来源:生物谷 作者:
顶一下
(0)
0%
踩一下
(0)
0%
------分隔线----------------------------
- 发表评论
-
- 最新评论 进入详细评论页>>
- 推荐内容
-
- 基因编辑新工具“出炉”以RNA为目
美国科学家日前发现一种新的基于CRISPR系统的基因编辑工具,它以...
- 章鱼和乌贼是RNA编辑高手,但DNA却
任何作家都会在编辑修改故事时抱怨,但改动一个词的后果通常...
- 新疆野苹果再生及CRISPR/Cas9基因编辑
2021-07-30 新疆生态与地理研究所 【字体:大 中 小】 语音播报...
- 美国将开展首例CRISPR抗癌人体试验
据英国《自然》杂志网站、美国《麻省理工技术评论》网站近日...
- 基因编辑技术有望治疗镰状细胞病
一个美国研究小组使用CRISPR-Cas9基因编辑技术,成功修复了镰状...
- DIY基因编辑技术让你无所不能
随着越来越多的新闻媒体报道CRISPR/Cas基因编辑的应用——尤其是...
- 基因编辑新工具“出炉”以RNA为目